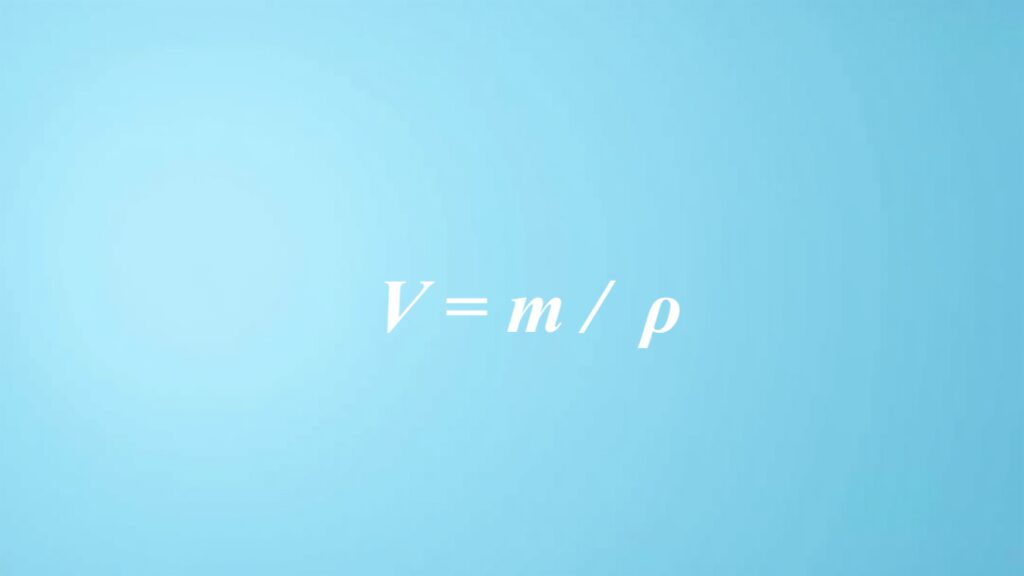Wzory na objętość w chemii
W chemii wzory obliczania objętości odgrywają kluczową rolę w zrozumieniu i badaniu właściwości substancji w różnych stanach skupienia. Dla cieczy i ciał stałych korzystamy z równania V = m/ρ, gdzie V to objętość, m masa substancji, a ρ gęstość. Umożliwia to szybkie ustalenie objętości, gdy znamy masę i gęstość materiału.
Gdy mówimy o gazach, sytuacja się komplikuje. Stosujemy wtedy równanie stanu gazu idealnego: PV = nRT. W tej formule P oznacza ciśnienie, V jest objętością gazu, n liczbą moli, R stałą gazową wynoszącą 8.314 J/(mol·K), a T temperaturą mierzoną w kelwinach. Dzięki równaniu Clapeyrona możemy precyzyjnie określić objętość gazu przy danym ciśnieniu i temperaturze.
Dodatkowo istotne jest przeliczanie jednostek takich jak centymetr sześcienny (cm³) czy litr (L). Wzory te są nieodzowne przy analizie reakcji chemicznych oraz eksperymentach laboratoryjnych. Precyzja obliczeń ma decydujące znaczenie dla sukcesu badań naukowych.
Wzór na objętość – chemia
W dziedzinie chemii wzór na obliczenie objętości jest niezbędny zarówno dla substancji stałych, jak i ciekłych. Podstawowe równanie to V = m/ρ, gdzie V oznacza objętość, m to masa materiału, a ρ (rho) określa jego gęstość. Dzięki temu prostemu wzorowi możemy łatwo przeliczać masę na objętość lub odwrotnie, co jest niezwykle użyteczne przy analizowaniu składu różnych materiałów.
Przykładowo, znając masę cieczy o ustalonej gęstości, szybko wyznaczymy jej objętość. Ten wzór znajduje zastosowanie nie tylko w laboratoriach chemicznych, ale także w branży farmaceutycznej oraz spożywczej. Natomiast dla gazów idealnych stosuje się równanie Clapeyrona (PV = nRT), które umożliwia określenie objętości gazu przy danym ciśnieniu i temperaturze. Różnorodność metod wykorzystywanych do obliczania objętości podkreśla złożoność tego zagadnienia oraz wagę dokładnych pomiarów i kalkulacji w nauce chemicznej.
Jak obliczyć objętość w chemii?
W chemii obliczanie objętości zależy od stanu materii i dostępnych informacji. Dla cieczy oraz ciał stałych najczęściej stosuje się wzór V = m / ρ, gdzie V to objętość, m oznacza masę substancji, a ρ jest jej gęstością. Przykładowo, jeśli mamy 150 gramów substancji o gęstości 3 g/cm³, to objętość wyniesie 50 cm³.
W przypadku gazów używa się natomiast równań gazu idealnego. Najbardziej popularne jest równanie Clapeyrona: PV = nRT. W tym równaniu P reprezentuje ciśnienie gazu, V to jego objętość, n oznacza liczbę moli gazu, R jest stałą gazową (8.314 J/(mol·K)), a T to temperatura w kelwinach. Dzięki temu równaniu można precyzyjnie określić objętość gazu przy znanym ciśnieniu i temperaturze.
Dodatkowo ważne jest stosowanie właściwych jednostek miary dla cieczy i gazów oraz dokładność danych wejściowych podczas przeprowadzania obliczeń.
Przekształcenie wzoru na gęstość
Przekształcanie wzoru na gęstość odgrywa kluczową rolę w chemii, zwłaszcza gdy zależy nam na obliczeniu objętości. Gęstość (ρ), definiowana jako stosunek masy (m) do objętości (V), zapisujemy równaniem ρ = m / V. Aby obliczyć objętość, możemy przekształcić ten wzór do formy V = m / ρ. Dzięki temu, mając dane dotyczące masy i gęstości substancji, łatwo ustalimy jej objętość.
Takie obliczenia są powszechnie stosowane w analizach chemicznych i pozwalają na określenie ilości substancji w różnych stanach skupienia. Na przykład, dysponując informacjami o masie ciała stałego bądź cieczy oraz ich gęstości, można bez trudu uzyskać ich objętość przy użyciu prostych operacji matematycznych.
Wzór na objętość jako przekształcenie wzoru na gęstość
Przekształcenie wzoru na gęstość umożliwia wyliczenie objętości, gdy mamy dane dotyczące masy i gęstości substancji. Podstawowy wzór wygląda tak: ρ = m / V, gdzie ρ to gęstość, m oznacza masę, a V reprezentuje objętość. Po przekształceniu uzyskujemy formułę V = m / ρ. Dzięki temu możemy szybko określić objętość dowolnej substancji w chemii, korzystając z dostępnych informacji o masie i gęstości. To znacznie ułatwia różnego rodzaju obliczenia w laboratorium oraz podczas analiz chemicznych.
Obliczanie objętości poprzez dzielenie masy przez gęstość
Obliczanie objętości poprzez podział masy przez gęstość to prosty, ale efektywny sposób wykorzystywany w chemii. Wzór V = m / d, gdzie V oznacza objętość, m reprezentuje masę, a d jest gęstością danej substancji, pozwala szybko oszacować objętość dowolnego związku chemicznego.
Przykładowo, jeśli mamy 100 gramów substancji o gęstości 2 g/cm³, możemy stwierdzić, że jej objętość wynosi 50 cm³. Ten matematyczny wzór jest kluczowy dla dokładnych obliczeń w laboratoriach chemicznych i innych naukach przyrodniczych. Co więcej, jego stosowanie ułatwia konwersję jednostek oraz porównywanie cech różnych substancji poprzez analizowanie ich masy i gęstości.
Praktyczne zastosowania wzoru na objętość
Wzór na objętość pełni kluczową rolę w chemii oraz wielu innych dziedzinach naukowych. W chemii umożliwia precyzyjne obliczenie objętości substancji, co jest niezbędne przy tworzeniu roztworów czy przeprowadzaniu reakcji chemicznych. Na przykład, korzystając ze wzoru V = m / ρ, można łatwo określić, ile litrów cieczy będzie potrzebne do reakcji, mając dane o jej masie i gęstości.
Jednostki objętości, takie jak litry (L) i centymetry sześcienne (cm³), odgrywają ważną rolę w tych kalkulacjach. Przeliczanie między tymi jednostkami zapewnia dokładność wyników, co jest istotne dla precyzji eksperymentów chemicznych. W laboratoriach często konieczne jest zamienianie cm³ na L i odwrotnie.
Poza chemią wzory na objętość są również użyteczne w budownictwie oraz inżynierii. Pozwalają one oszacować pojemność zbiorników czy ilość materiałów potrzebnych do budowy. Codziennie pomagają także lepiej zrozumieć ilości płynów czy przestrzeń wewnątrz opakowań.
Zastosowanie wzorów obejmuje również geometrię przestrzenną oraz projektowanie architektoniczne. Kluczowe jest tutaj określenie pojemności takich struktur jak ostrosłupy czy prostopadłościany. Dzięki swojej uniwersalności wzór ma zastosowanie zarówno do ciał stałych, jak i cieczy o różnych właściwościach.
Obliczanie objętości substancji chemicznych
Obliczanie objętości substancji chemicznych odgrywa istotną rolę w wielu procesach. Wzór V = m / ρ, gdzie V to objętość, m oznacza masę, a ρ gęstość, umożliwia precyzyjne określenie tej wielkości. Jest to szczególnie ważne przy przygotowywaniu roztworów oraz podczas przeprowadzania reakcji chemicznych.
Przykładowo, mając masę wynoszącą 150 gramów i gęstość równą 3 g/cm³, obliczamy objętość jako V = 150 g / 3 g/cm³, co daje wynik 50 cm³.
Używanie odpowiednich jednostek miary, takich jak litry czy centymetry sześcienne, znacznie ułatwia pracę z różnorodnymi substancjami w laboratorium.
Jednostki i zamiana jednostek objętości
W chemii najczęściej stosowanymi jednostkami objętości są litry (L) i centymetry sześcienne (cm³). Wiemy, że 1 litr to 1000 cm³. Przeliczanie tych jednostek jest kluczowe przy przygotowywaniu roztworów oraz w obliczeniach chemicznych.
Na przykład, jeśli chcemy zamienić 500 cm³ na litry, wystarczy podzielić przez 1000, co daje wynik 0,5 L. Podobnie, przy przeliczaniu metrów sześciennych (m³) na decymetry sześcienne (dm³), należy pamiętać, że 1 m³ odpowiada 1000 dm³. Utrzymanie jednolitości jednostek w obliczeniach pozwala uniknąć pomyłek i zapewnia dokładność wyników.
Objętość w kontekście gazów
Obliczanie objętości gazów odgrywa kluczową rolę w chemii, zwłaszcza gdy analizujemy ich zachowanie pod różnymi warunkami. Równanie Clapeyrona, znane również jako równanie stanu gazu doskonałego, jest podstawowym narzędziem w tych obliczeniach. Wzór ten przedstawia się jako PV = nRT, gdzie:
- p oznacza ciśnienie,
- v to objętość,
- n to liczba moli gazu,
- r to uniwersalna stała gazowa (8.314 J/(mol·K)),
- t to temperatura wyrażona w kelwinach.
Stosując równanie Clapeyrona, możemy precyzyjnie określić objętość gazu przy znajomości pozostałych parametrów. Na przykład wzrost temperatury skutkuje zwiększeniem objętości przy niezmienionym ciśnieniu w procesie izobarycznym. Z kolei podczas przemiany izotermicznej ciśnienie wpływa odwrotnie proporcjonalnie na objętość.
- prawo Boyle’a ilustruje związek między ciśnieniem i objętością przy stałej temperaturze poprzez równanie PV = constans,
- prawo Charles’a wskazuje, że objętość jest proporcjonalna do temperatury przy stałym ciśnieniu: V/T = constans,
- prawo Gay-Lussaca opisuje relację między ciśnieniem a temperaturą przy ustalonej objętości: P/T = constans.
Standardowe warunki dla gazów wynoszą 0°C (273 K) oraz 1 atm, natomiast normalne warunki to 20°C (293 K) i 1 atm. Znajomość tych praw oraz standardowych i normalnych warunków umożliwia przewidywanie zmian zachowania gazów i dokładne ich obliczenia w różnych procesach chemicznych.
Objętość gazu i równanie Clapeyrona
Równanie Clapeyrona, powszechnie znane jako równanie stanu gazu doskonałego, odgrywa istotną rolę w obliczaniu objętości gazów. Przyjmuje ono postać PV = nRT, gdzie:
- P to ciśnienie,
- V oznacza objętość,
- n jest liczbą moli,
- R stanowi stałą gazową o wartości 8.314 J/(mol·K),
- T to temperatura wyrażona w kelwinach.
Dzięki temu równaniu można dokładnie określić objętość gazów przy różnych poziomach ciśnienia i temperatury.
Aby efektywnie korzystać z tego równania w zadaniach chemicznych, niezbędne jest zrozumienie wpływu poszczególnych parametrów. Przykładowo, gdy ciśnienie wzrasta przy zachowaniu stałej liczby moli i temperatury, objętość gazu maleje. Z kolei podniesienie temperatury przy utrzymaniu stałego ciśnienia prowadzi do zwiększenia objętości.
Równanie Clapeyrona znajduje zastosowanie nie tylko w teoretycznych modelach chemii, lecz także w przemyśle oraz badaniach naukowych dotyczących zachowania gazów w rozmaitych warunkach atmosferycznych. Warto jednak pamiętać, że najdokładniej opisuje gazy doskonałe; dla rzeczywistych należy uwzględnić poprawki wynikające z ich odchylenia od idealnego modelu.
Prawo Boyle’a, Charles’a i Gay-Lussaca
Boyle’a, Charles’a i Gay-Lussaca to fundamentalne zasady pomagające w zrozumieniu zachowania gazów:
- Prawo Boyle’a wskazuje, że przy stałej temperaturze zmniejszanie się objętości gazu następuje wraz ze wzrostem ciśnienia (V ∝ 1/P), co jest szczególnie użyteczne przy przewidywaniu zmian w sprężonych gazach,
- prawo Charles’a opisuje zależność między objętością a temperaturą pod stałym ciśnieniem (V ∝ T), sugerując, że podgrzewanie gazu prowadzi do jego rozszerzenia,
- prawo Gay-Lussaca koncentruje się na relacji między ciśnieniem a temperaturą przy ustalonej objętości (P ∝ T), co jest kluczowe dla zrozumienia dynamiki ciśnienia w zamkniętych pojemnikach.
Te zasady są nieocenione w chemii i fizyce do modelowania zjawisk związanych z gazami oraz wykonywania obliczeń opartych na równaniu Clapeyrona i innych procesach termodynamicznych.
Warunki standardowe i normalne dla gazów
Warunki standardowe i normalne odgrywają ważną rolę w chemii, pomagając zrozumieć, jak zachowują się gazy. Standardowe warunki zakładają ciśnienie 1 atm oraz temperaturę wynoszącą 0°C (273,15 K). W takich okolicznościach jeden mol gazu idealnego zajmuje około 22,4 litra przestrzeni. Stanowią one kluczowy punkt odniesienia dla obliczeń dotyczących objętości gazów.
Z kolei warunki normalne także przewidują ciśnienie równe 1 atm, lecz temperatura wynosi tutaj już 20°C. Te parametry są niezwykle istotne ze względu na ich powszechność w eksperymentach i kalkulacjach związanych z właściwościami gazów doskonałych.
Różnice między tymi dwoma zestawami parametrów pozwalają na precyzyjne obliczenia objętości gazu przy użyciu wzorów uwzględniających ciśnienie i temperaturę, takich jak równanie Clapeyrona czy prawo Boyle’a. Prawidłowe stosowanie tych norm umożliwia dokładniejsze przewidywanie zachowań gazowych w różnych kontekstach laboratoryjnych i przemysłowych.