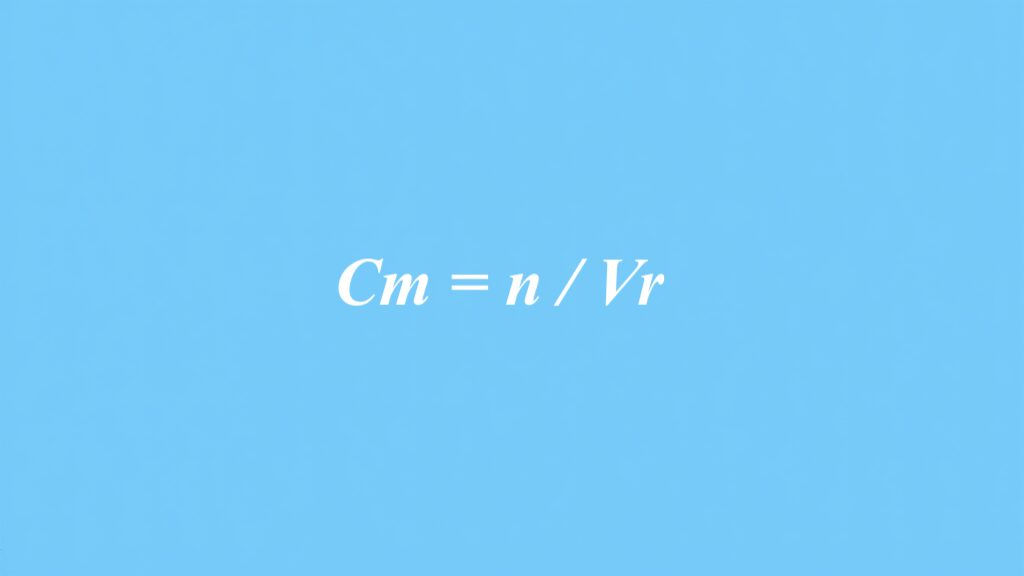Wzór na stężenie molowe
Wzór na stężenie molowe, oznaczany jako Cm, określa ilość moli substancji rozpuszczonej w jednym decymetrze sześciennym roztworu. Można go wyrazić za pomocą równania: Cm = n / Vr, gdzie n to liczba moli danej substancji, a Vr reprezentuje objętość roztworu w dm³. Jednostką stężenia molowego jest mol/dm³, co stanowi standardowy sposób mierzenia koncentracji w dziedzinie chemii.
Stężenie molowe odgrywa istotną rolę podczas przygotowywania i analizy roztworów chemicznych. Umożliwia dokładne określenie proporcji składników w reakcjach oraz jest kluczowe dla obliczeń stechiometrycznych.
Dzięki temu wzorowi można łatwo przeliczać inne jednostki koncentracji, takie jak stężenie procentowe, o ile znamy gęstość roztworu i masę molową substancji. To czyni go wszechstronnym narzędziem dla chemików pracujących zarówno z wodnymi mieszaninami, jak i innymi rozpuszczalnikami.
Poznanie tego wzoru oraz umiejętność jego stosowania są nieodzowne dla każdego studenta czy specjalisty zajmującego się chemią analityczną lub przemysłową.
Jednostki stężenia molowego: mol/dm³
Jednostka stężenia molowego, wyrażana jako mol/dm³ (mol•dm⁻³), określa ilość moli substancji rozpuszczonej w jednym decymetrze sześciennym roztworu. Przykładowo, gdy mamy stężenie 0,1 mol/dm³, oznacza to obecność 0,1 mola substancji w 1 dm³ cieczy. Jest to niezwykle istotna wielkość w chemii, ponieważ umożliwia precyzyjne określenie ilości składnika w danej objętości płynu. Dzięki niej możemy uzyskać dokładne wyniki podczas obliczeń chemicznych oraz przygotowywania roztworów o pożądanym stężeniu.
Obliczanie liczby moli i objętości roztworu
Aby ustalić liczbę moli substancji w roztworze, korzystamy z prostego wzoru: n = ms / Ms. W tym równaniu potrzebujemy masy substancji (ms) oraz jej masy molowej (Ms). Przykładowo, jeśli posiadamy 10 g substancji o masie molowej 50 g/mol, to uzyskujemy 0,2 mola.
Kolejnym krokiem jest wyznaczenie objętości roztworu (Vr). Możemy to zrobić za pomocą wzoru na stężenie molowe: Vr = n / Cm. Przyjmując, że stężenie molowe (Cm) wynosi 0,5 mol/dm³ i dysponujemy 0,2 mola substancji, objętość roztworu wyniesie 0,4 dm³.
Takie obliczenia mają istotne znaczenie w chemii analitycznej. Umożliwiają precyzyjne przygotowanie roztworów o określonych stężeniach. Dzięki temu zyskujemy kontrolę nad przebiegiem reakcji chemicznych oraz możemy przeprowadzać eksperymenty z dużą dokładnością.
Praktyczne zastosowanie wzoru Cm = n / V
Wzór Cm = n / V jest szeroko wykorzystywany zarówno w laboratoriach, jak i przemyśle. W pracowniach chemicznych pozwala na precyzyjne przygotowanie roztworów o określonym stężeniu molowym, co ma kluczowe znaczenie dla dokładności eksperymentów. Dzięki temu można kontrolować ilość reagujących substancji chemicznych, co bezpośrednio wpływa na przebieg reakcji.
Przykładowo, wzór ten umożliwia stworzenie roztworu chlorku sodu (NaCl) o konkretnej koncentracji molowej. Znając liczbę moli NaCl oraz objętość wody destylowanej, łatwo obliczyć odpowiednie proporcje składników. W podobny sposób, w przemyśle farmaceutycznym wzór pomaga w formułowaniu leków o precyzyjnym składzie chemicznym, co jest istotne dla ich efektywności i bezpieczeństwa.
Dodatkowo, Cm = n / V odgrywa ważną rolę w analizie wyników eksperymentów chemicznych oraz optymalizacji procesów technologicznych. Na przykład podczas produkcji środków czystości kluczowe jest uzyskanie właściwych stężeń aktywnych składników chemicznych w produktach końcowych.
Stężenie molowe roztworu
Stężenie molowe to kluczowe zagadnienie w chemii, które określa liczbę moli substancji w jednym decymetrze sześciennym (1 dm³) roztworu. Dzięki temu można precyzyjnie ustalić ilość danej substancji w konkretnej objętości. Wzór na stężenie molowe przedstawia się jako Cm = n / V, gdzie „n” oznacza liczbę moli, a „V” to objętość roztworu wyrażona w dm³. Tego rodzaju jednostkę często wykorzystuje się w laboratoriach oraz przy wszelkich obliczeniach chemicznych, które wymagają dokładnego przygotowania roztworów.
Zrozumienie różnic między stężeniem molowym a procentowym jest istotne dla praktycznych zastosowań. Stężenie procentowe odnosi się do masy lub objętości składnika względem całkowitej masy lub objętości mieszaniny i pomija liczbę moli rozpuszczonej substancji, co czyni je mniej dokładnym przy równaniach stechiometrycznych. Natomiast stężenie molowe umożliwia precyzyjne przeliczanie i przewidywanie reakcji chemicznych, co jest nieocenione podczas syntezy nowych związków czy analizy składu substancji.
Dodatkowo wzór Cm = n / V pomaga kontrolować właściwości fizykochemiczne roztworów oraz dostosowywać je zgodnie z wymogami badań naukowych czy produkcji przemysłowej.
Różnice między stężeniem molowym a procentowym
Stężenie molowe i procentowe różnią się głównie sposobem przedstawiania ilości substancji w roztworze. Stężenie molowe (Cm) informuje, ile moli danej substancji znajduje się w określonej objętości roztworu, co ułatwia precyzyjne obliczenia chemiczne. Jego jednostką jest mol na decymetr sześcienny (mol/dm³). Natomiast stężenie procentowe (Cp) pokazuje masę substancji w 100 gramach roztworu, co obrazuje proporcje masy składników.
Te różnice mają znaczenie przy wyborze metody analizy chemicznej. W obliczeniach stechiometrycznych, gdzie istotna jest liczba cząsteczek, stężenie molowe okazuje się niezastąpione. Z kolei stężenie procentowe jest bardziej intuicyjne podczas oceny składu produktów codziennego użytku, takich jak kosmetyki czy żywność.
Przykładowe zastosowania:
- w laboratoriach naukowych chętnie sięga się po stężenia molowe do precyzyjnych reakcji chemicznych,
- analiz instrumentalnych,
- w przemyśle spożywczym i farmaceutycznym częściej używa się stężeń procentowych,
- konsumenci mogą łatwo zrozumieć zawartość składników danego produktu.
Jak przeliczyć stężenie procentowe na stężenie molowe?
Aby przeliczyć stężenie procentowe na molowe, potrzebujemy trzech parametrów:
- stężenia procentowego (Cp),
- gęstości roztworu (dr),
- masy molowej substancji (M).
Cały proces zaczyna się od zastosowania wzoru: Cm = (Cp * dr) / (M * 100%). Gęstość wyrażamy w gramach na decymetr sześcienny (g/dm³). Dzięki temu wzorowi możemy określić ilość moli substancji zawartych w jednym litrze roztworu, czyli jego stężenie molowe.
Przykładowo, dla roztworu z Cp = 10%, dr = 1200 g/dm³ i M = 58,5 g/mol chlorku sodu, Cm wynosi około 2,05 mol/dm³. Tego rodzaju obliczenia są niezwykle istotne w chemii analitycznej i technologii przemysłowej. Umożliwiają precyzyjne określenie ilości substancji czynnej w różnych mieszankach chemicznych.
Kroki przeliczania stężenia
Aby przeliczyć stężenie procentowe na molowe, należy wykonać kilka kroków:
- obliczyć masę substancji rozpuszczonej (ms) na podstawie podanego stężenia procentowego (Cp),
- określić całkowitą masę roztworu (mr), korzystając z dostępnej gęstości,
- użyć wzoru ms = n * M, który pozwala wyznaczyć liczbę moli substancji rozpuszczonej (n), gdzie M oznacza masę molową,
- aby uzyskać objętość roztworu (Vr), skorzystać z relacji między liczbą moli a stężeniem molowym (Cm).
Te działania są kluczowe dla precyzyjnego przeliczania różnych stężeń chemicznych w laboratorium.
Przykłady obliczeń chemicznych
Przykłady obliczeń chemicznych często dotyczą przeliczania między stężeniem procentowym a molowym, z uwzględnieniem gęstości roztworu. Weźmy na przykład 98% roztwór kwasu siarkowego (H2SO4) o gęstości 1,84 g/cm³. Możemy obliczyć jego stężenie molowe, przeliczając najpierw gęstość na dm³, co daje wartość 1840 g/dm³. Następnie stosuje się wzór Cm = n / V, gdzie 'n’ to liczba moli, a 'V’ to objętość w dm³.
Podobnie dla kwasu solnego (HCl) o stężeniu molowym 12,4 mol/dm³ i gęstości 1,19 g/cm³ można określić jego stężenie procentowe. W tym przypadku konieczna jest konwersja jednostek za pomocą odpowiednich wzorów oraz uwzględnienie masy cząsteczkowej HCl do dokładnej konwersji wartości.
Sporządzanie roztworów o zadanym stężeniu molowym
Aby stworzyć roztwór o konkretnej koncentracji molowej, najpierw musimy określić masę substancji, którą zamierzamy rozpuścić. Podstawą tego procesu jest wzór na stężenie molowe: Cm = n / V, gdzie n oznacza liczbę moli substancji, a V to objętość roztworu wyrażona w dm³. Na początek ustalamy liczbę moli (n) przy użyciu masy (m) i masy molowej (M), stosując równanie n = m / M.
Kolejnym krokiem jest ustalenie wymaganej ilości rozpuszczalnika. Jeśli znamy wartość Cm i chcemy przygotować określoną ilość roztworu, dostosowujemy ilość substancji lub objętość według wzoru Cm = n / V. Na przykład, aby otrzymać 1 dm³ roztworu o stężeniu 0,5 mol/dm³ z substancji o ciężarze cząsteczkowym 58 g/mol, należy obliczyć właściwą masę: m = 0,5 * 58 g = 29 g.
Po dokładnym odważeniu tej porcji rozpuszczamy ją w części rozpuszczalnika. Następnie dolewamy do pełnej wymaganej objętości za pomocą menzurki lub kolby miarowej. Istotne jest staranne mieszanie oraz kontrola temperatury procesu, gdyż wpływa ona na rozpuszczalność i cechy fizyczne roztworu.
Dokładny pomiar i unikanie błędów jednostkowych są kluczowe dla osiągnięcia pożądanego stężenia molowego. Wykorzystanie precyzyjnego sprzętu laboratoryjnego i odpowiednich technik pracy pomaga zminimalizować błędy podczas przygotowywania roztworów chemicznych.
Kontrola dokładności i błędy jednostek
Kontrola jednostek w chemii ma kluczowe znaczenie, aby uniknąć pomyłek w obliczeniach. Gęstość roztworu wyrażamy w g/dm³, masę podajemy w gramach, a objętość mierzymy w dm³. Niezgodność tych jednostek może prowadzić do błędnych wyników. Dlatego przed rozpoczęciem jakichkolwiek obliczeń warto się upewnić, że wszystkie wartości są zgodne i właściwie przeliczone. To istotne zwłaszcza podczas przygotowywania roztworów o określonym stężeniu molowym. Precyzja pomiarów wpływa na końcowy rezultat eksperymentu.