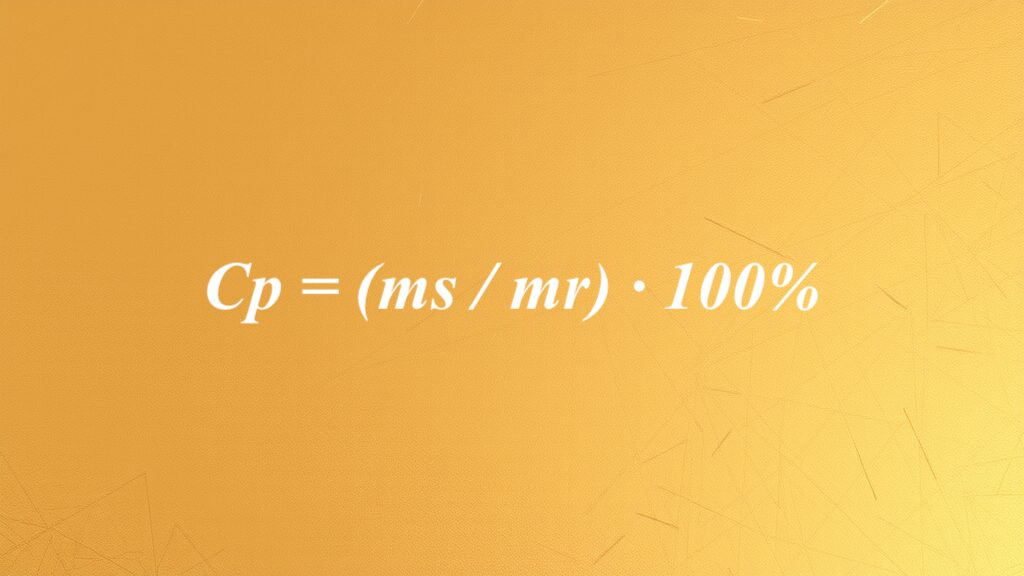Co oznacza stężenie procentowe roztworu?
Stężenie procentowe roztworu to informacja o ilości gramów substancji rozpuszczonej w 100 gramach całego roztworu, oznaczane jako Cp. Oblicza się je, dzieląc masę substancji rozpuszczonej przez masę roztworu i mnożąc przez 100%. Taki sposób obliczeń umożliwia precyzyjne ustalenie procentowej zawartości konkretnego składnika w danej mieszance.
Zrozumienie stężenia procentowego jest niezwykle ważne w chemii. Jest to kluczowa informacja przy:
- tworzeniu roztworów o określonych właściwościach,
- przeprowadzaniu analiz chemicznych,
- kontroli jakości w laboratoriach.
Uwzględnia ono zarówno masę substancji rozpuszczonej, jak i masę całego roztworu, co zapewnia dokładne określenie zawartości procentowej różnych składników.
Jakie są rodzaje stężenia procentowego?
Stężenie procentowe można podzielić na dwa główne typy: procent masowy oraz procent objętościowy. Procent masowy wskazuje, ile z masy roztworu stanowi masa substancji rozpuszczonej. Na przykład, jeśli mamy 100 g roztworu i 10 g substancji, to stężenie procentowe masowe wynosi 10%.
Natomiast procent objętościowy odnosi się do proporcji objętości konkretnego składnika w stosunku do objętości całego roztworu. Ma to szczególne znaczenie w przypadku łączenia płynów, takich jak alkohol z wodą. Wybór między tymi dwoma rodzajami stężenia procentowego zależy od charakterystyki roztworu oraz celu analizy.
Oba te typy stężenia są kluczowe dla prawidłowego obliczania ilości składników oraz tworzenia roztworów o określonych właściwościach fizykochemicznych. Ważne jest także to, że przy przeliczaniu pomiędzy stężeniem masowym a objętościowym, często trzeba uwzględnić gęstość roztworu.
Stężenie procentowe masowe
Stężenie procentowe masowe to miara, która pokazuje, jaką część całkowitej masy roztworu zajmuje substancja rozpuszczona, a wyrażona jest w procentach. Aby je obliczyć, stosuje się prosty wzór:
Cp = (ms / mr) × 100%
w którym ms odnosi się do masy substancji, a mr do masy całego roztworu.
Zazwyczaj przyjmuje się gramy jako jednostkę masy, co zapewnia spójność i dokładność obliczeń. Ta metoda jest niezwykle przydatna w chemii, szczególnie podczas precyzyjnego określania proporcji poszczególnych składników w roztworach.
Znalezienie wartości masy substancji w stosunku do masy całego roztworu umożliwia precyzyjne wyliczenie stężenia procentowego masowego. Co więcej, znajomość stężenia pozwala lepiej zarządzać składem oraz charakterystyką roztworów, co jest istotne w różnorodnych badaniach i zastosowaniach.
Stężenie procentowe objętościowe
Stężenie procentowe objętościowe informuje nas, jaką część całkowitej objętości roztworu stanowi substancja rozpuszczona, a rezultat przedstawia się w postaci procentów. Aby je obliczyć, należy wykonać następujące kroki:
- podzielić objętość danej substancji przez objętość całego roztworu,
- przemnożyć przez 100%.
Ta metoda obliczeń jest szeroko stosowana w przypadku roztworów cieczy, ponieważ pomiar objętości jest zazwyczaj prostszy niż masa.
Dodatkowo, wiedza na temat gęstości roztworu jest niezwykle wartościowa, ponieważ ułatwia konwersję między objętością a masą. Stężenie objętościowe odgrywa kluczową rolę w branży farmaceutycznej oraz spożywczej, gdzie precyzyjne dozowanie płynnych składników wymaga skrupulatnej kontroli ich procentowej zawartości.
Obliczanie stężenia procentowego objętościowego umożliwia szybkie określenie, jaki procent objętości stanowią poszczególne składniki w danej mieszaninie.
Jak brzmi wzór na stężenie procentowe?
Wzór na stężenie procentowe wskazuje, jaką część masy substancji rozpuszczonej stanowi masa całego roztworu. Aby obliczyć to stężenie, należy pomnożyć ten stosunek przez 100%. Mamy zatem równanie Cp = (ms / mr) × 100%, gdzie Cp to stężenie procentowe, ms reprezentuje masę substancji, a mr to masa całego roztworu.
Ten wzór odgrywa istotną rolę w chemii. Umożliwia precyzyjne wyliczanie stężenia, co jest konieczne przy:
- przygotowywaniu roztworów w zamierzonych proporcjach,
- analizie składników roztworów,
- określaniu ilości substancji w roztworze,
- realizacji różnych zastosowań chemicznych,
- uzyskaniu powtarzalnych wyników w badaniach laboratoryjnych.
Dzięki tej formule możemy dokładnie określić ilość substancji obecnej w roztworze, co jest niezwykle ważne w różnych zastosowaniach chemicznych.
Wyjaśnienie oznaczeń we wzorze
Wzór na stężenie procentowe, wyrażony jako Cp = (ms / mr) * 100%, ma kluczowe znaczenie w chemii.
- ms to masa substancji rozpuszczonej w roztworze, innymi słowy, jest to ilość materiału, dla którego obliczamy stężenie,
- mr odnosi się do masy całkowitej roztworu, która obejmuje zarówno masę substancji rozpuszczonej, jak i masę rozpuszczalnika,
- Cp reprezentuje stężenie procentowe, które prezentujemy w formie procentów masowych.
Dzięki znajomości tych oznaczeń z łatwością można wykorzystać wzór, co umożliwia precyzyjne obliczenie stężenia procentowego w danym roztworze.
Jak obliczyć stężenie procentowe roztworu krok po kroku?
Aby obliczyć stężenie procentowe roztworu, warto postępować zgodnie z pewnymi krokami:
- zmierz masę substancji rozpuszczonej (ms),
- zmierz masę całego roztworu (mr),
- jeśli używasz różnych jednostek masy, przelicz je, aby uzyskać spójność.
Następnie, wprowadź te wartości do wzoru na stężenie procentowe: Cp = (ms / mr) × 100%. Otrzymany wynik pokazuje, jaki procent masy substancji znajduje się w 100 gramach roztworu.
Gdy obliczenia dotyczą objętości roztworu, ważne jest, aby wziąć pod uwagę gęstość tego roztworu. Umożliwi to właściwe przeliczenie masy na objętość lub odwrotnie. Precyzyjne ustalanie proporcji oraz dokładność pomiarów są niezbędne, aby uniknąć błędów w obliczeniach chemicznych i uzyskać pożądany roztwór.
Przykład obliczenia stężenia procentowego
Przykład obliczania stężenia procentowego polega na podzieleniu masy substancji rozpuszczonej przez masę całego roztworu, a następnie pomnożeniu uzyskanego wyniku przez 100%. Na przykład, jeżeli w 100 g roztworu znajduje się 10 g substancji, obliczamy stężenie procentowe w ten sposób: (10 g / 100 g) × 100% = 10%.
Ten przykład ułatwia zrozumienie wzoru oraz jego praktycznego zastosowania w chemii. Dokładne ustalenie stężenia procentowego ma fundamentalne znaczenie w różnorodnych zadaniach oraz eksperymentach chemicznych. Dlatego warto zapoznać się z tą metodą obliczeń, aby lepiej pojąć procesy zachodzące w roztworach.
Jaką rolę pełni stężenie procentowe w chemii analitycznej?
Stężenie procentowe odgrywa istotną rolę w chemii analitycznej, ponieważ pozwala na precyzyjne określenie składu roztworów i substancji chemicznych. Przygotowanie roztworów o ściśle zdefiniowanych proporcjach jest kluczowe dla skuteczności badań w tej dziedzinie.
W kontroli jakości, znajomość stężenia procentowego jest fundamentalna do monitorowania poziomu różnych składników, co z kolei wpływa na spójność wyników. Dla przykładu, w miareczkowaniu oraz innych technikach analitycznych, dokładne ustalenie stężenia jest wręcz niezbędne. Te metody wymagają precyzyjnych informacji na temat koncentracji substancji w próbkach.
Co więcej, stężenie procentowe przyczynia się do zwiększenia wiarygodności oraz dokładności w badaniach naukowych i procesach przemysłowych. Dzięki temu analizy chemiczne są bardziej efektywne, co w rezultacie prowadzi do lepszych wyników.
Zastosowanie w laboratoriach i kontroli jakości
W laboratoriach precyzyjne procentowe stężenie odgrywa kluczową rolę w przygotowywaniu roztworów o określonym składzie. Dzięki niemu możliwe jest powtarzanie eksperymentów chemicznych oraz przeprowadzanie dokładnych analiz.
W ramach kontroli jakości, procentowe stężenie stanowi wskaźnik czystości oraz właściwości różnych produktów, takich jak:
- chemikalia,
- farmaceutyki,
- artykuły spożywcze.
Skrupulatne obliczenia i pomiary stężenia pomagają w identyfikacji odchyleń oraz błędów, co przekłada się na większe bezpieczeństwo procesów produkcyjnych i sprawność gotowych produktów.
Dodatkowo, korzystanie z tej metody umożliwia stałe monitorowanie zgodności z normami i utrzymanie wysokiej jakości, zarówno w laboratoriach, jak i w zakładach produkcyjnych.
Stężenie procentowe a miareczkowanie
W miareczkowaniu kluczowym aspektem jest stężenie procentowe roztworu. To ono odgrywa istotną rolę w zapewnieniu dokładności oraz powtarzalności wyników podczas analiz chemicznych. Dokładne ustalenie stężenia procentowego roztworu miareczkowego umożliwia uzyskanie roztworów o stałym składzie, co jest niezbędne do precyzyjnego określenia ilości badanej substancji w próbce.
Ostatecznie, stężenie procentowe wpływa na:
- wiarygodność miareczkowania,
- precyzję wyników,
- przygotowanie roztworów w innych technikach chemii analitycznej.
Jak konwersja jednostek wpływa na obliczenia stężenia procentowego?
Konwersja jednostek odgrywa kluczową rolę w dokładności obliczeń związanych ze stężeniem procentowym. Stężenie procentowe określa proporcję masy substancji rozpuszczonej do całkowitej masy roztworu lub objętości substancji w stosunku do objętości całego roztworu. Dlatego precyzyjne określenie jednostek masy i objętości jest niezbędne dla uzyskania poprawnych wyników.
Najczęściej stosowaną jednostką masy jest gram, ale niekiedy zachodzi potrzeba przeliczenia miligramów, kilogramów lub innych jednostek na gramy. W kontekście stężenia objętościowego, ważnym czynnikiem jest gęstość roztworu, która pozwala na przekład masy na objętość.
Niewłaściwa konwersja masy lub objętości może prowadzić do znaczących nieścisłości w obliczeniach, co z kolei może skutkować błędnym określeniem stężenia procentowego. Z tego powodu kluczowe jest stosowanie właściwych jednostek i uwzględnienie gęstości roztworu, co zapewnia wiarygodność i precyzję obliczeń chemicznych.
Jakie są najczęstsze błędy przy obliczaniu stężenia procentowego?
Najczęstsze problemy związane z obliczaniem stężenia procentowego wynikają z błędnego stosowania jednostek masy i objętości. Wielu ludzi myli te dwie kategorie, co prowadzi do nieprawidłowych wyników. Ignorowanie konwersji jednostek, na przykład przekształcanie gramów na mililitry, wprowadza dodatkowe nieścisłości.
Co więcej, w trakcie przeliczania objętości na masę (lub odwrotnie) często nie bierze się pod uwagę gęstości roztworu, co może zaburzyć dokładność obliczeń. Również niewłaściwe ważenie składników i błędne stosowanie wzoru na obliczanie stężenia procentowego przyczyniają się do powstawania błędów.
W chemii te niedokładności mogą prowadzić do istotnych odchyleń w wynikach doświadczeń. Dlatego kluczowe jest, aby dbać o precyzję i konsekwencję w posługiwaniu się jednostkami. Uwzględnienie wszystkich istotnych parametrów, takich jak gęstość roztworu, jest niezbędne, aby uzyskać rzetelne rezultaty.
Czym różni się roztwór nasycony, stężony i rozcieńczony?
Roztwór nasycony zawiera maksymalną ilość substancji, jaką można rozpuścić w danym rozpuszczalniku przy określonych warunkach temperatury i ciśnienia. W praktyce oznacza to, że dodawanie kolejnych porcji rozpuszczalnika nie spowoduje wzrostu rozpuszczonej substancji; wszelki nadmiar pozostaje w formie nierozpuszczonej.
Roztwór stężony ma wysokie stężenie substancji, lecz nie zawsze jest to równoznaczne z osiągnięciem pełnego nasycenia. Czasami można jeszcze dodać więcej danej substancji, mimo że jej ilość w roztworze wydaje się znaczna. Natomiast gdy mówimy o roztworze rozcieńczonym, wyróżnia się on niskim stężeniem substancji, w którym przeważa rozpuszczalnik.
Zrozumienie tych różnic jest niezwykle ważne w chemii analitycznej. Odpowiednia wiedza na ten temat ma kluczowe znaczenie podczas przygotowywania roztworów o ściśle określonych właściwościach oraz w trakcie przeprowadzania badań ilościowych.
Jak przygotować roztwór o zadanym stężeniu procentowym?
Przygotowanie roztworu o określonym stężeniu procentowym wiąże się z kilkoma krokami. Należy:
- odważyć odpowiednią masę substancji, którą zamierzamy rozpuścić,
- dobrać właściwą ilość rozpuszczalnika,
- zapoznać się ze wzorem na stężenie procentowe: Cp = (ms / mr) * 100%, gdzie ms oznacza masę substancji rozpuszczonej, a mr to całkowita masa roztworu.
Cała procedura opiera się na precyzyjnym ważeniu składników. Właściwe proporcje są kluczowe, aby osiągnąć zamierzone stężenie. Na przykład, przy przeliczaniu objętości, ważne jest uwzględnienie gęstości roztworu, co umożliwia prawidłowe przeliczenie masy na objętość i odwrotnie. Taki roztwór zapewnia zachowanie pożądanych właściwości i jest nieodzownym elementem w precyzyjnych analizach chemicznych oraz pracach laboratoryjnych.
Do czego wykorzystuje się kalkulatory stężenia procentowego?
Kalkulatory stężenia procentowego to niezwykle przydatne narzędzia, które umożliwiają szybkie i dokładne określenie stężenia roztworów. Opierają się na danych dotyczących masy substancji oraz masy lub objętości całego roztworu, co znacząco upraszcza proces przygotowywania rozwiązań o konkretnym stężeniu. Jest to kluczowe, szczególnie w środowisku laboratoriów oraz branży chemicznej.
Korzystając z tych kalkulatorów, można nie tylko:
- przeprowadzać analizy chemiczne,
- skutecznie kontrolować jakość produktów,
- zmniejszać ryzyko błędów obliczeniowych,
- zwiększać wydajność pracy,
- wspierać uczniów w rozwiązywaniu chemicznych zadań.
Dzięki nim znacznie zmniejsza się ryzyko błędów obliczeniowych, co w efekcie przyczynia się do zwiększenia wydajności pracy. Te narzędzia mają także swoje miejsce w edukacji, gdzie wspierają uczniów w rozwiązywaniu chemicznych zadań, pomagając im obliczać stężenia oraz badać właściwości roztworów.
Jak stężenie procentowe odnosi się do innych sposobów wyrażania stężenia?
Stężenie procentowe wskazuje, jaką część substancji zawiera roztwór, przy czym wyrażane jest jako procent masy lub objętości. Molarność definiuje liczbę moli substancji rozpuszczonej w każdym litrze roztworu. Innym pojęciem jest molalność, która odnosi się do ilości moli substancji przypadającej na jeden kilogram rozpuszczalnika.
Gęstość roztworu odgrywa kluczową rolę, umożliwiając przeliczanie stężenia procentowego na molarność oraz molalność. Dzięki niej można precyzyjnie określić zarówno masę, jak i objętość roztworu. Zrozumienie tych relacji jest niezwykle ważne, ponieważ pozwala na dokładne obliczenia chemiczne oraz skuteczne porównywanie różnych metod wyrażania stężenia.
Molarność i jej relacja do stężenia procentowego
Molarność określa ilość moli substancji rozpuszczonej w jednym litrze roztworu. Aby przeliczyć molarność na stężenie procentowe, istotne jest, aby uwzględnić masę molową danej substancji oraz gęstość roztworu.
Stężenie procentowe ilustruje, jaką część masy danej substancji stanowi ona w łącznej masie roztworu. Proces przeliczania między tymi dwoma parametrami wymaga kilku kroków:
- obliczamy masę substancji poprzez pomnożenie molarności przez masę molową,
- następnie tę wartość porównujemy do całkowitej masy roztworu, którą uzyskujemy, mnożąc objętość roztworu przez jego gęstość.
Te obliczenia pozwalają z dużą precyzją określić stężenie substancji w różnych jednostkach miary. Jest to szczególnie istotne w analizach chemicznych oraz procesach syntez, gdzie dokładność ma fundamentalne znaczenie.
Molalność a stężenie procentowe
Molalność to miara określająca liczbę moli substancji rozpuszczonej w jednym kilogramie rozpuszczalnika. Z drugiej strony, stężenie procentowe wyraża masę substancji w stosunku do 100 części masy całkowitego roztworu. Ważną różnicą pomiędzy tymi dwoma pojęciami jest to, że molalność nie jest uzależniona od objętości roztworu, podczas gdy dla stężenia procentowego kluczowa jest całkowita masa roztworu.
Aby przeliczyć molalność na stężenie procentowe, musimy znać masy zarówno rozpuszczalnika, jak i substancji, a także ich masy molowe. Przy obliczeniach dla molalności kluczowa jest masa rozpuszczalnika, natomiast w przypadku stężenia procentowego istotna jest masa całkowita roztworu.
Molalność znajduje szerokie zastosowanie w chemii, zwłaszcza gdy zachodzą zmiany w temperaturze i ciśnieniu, które wpływają na objętość roztworu. W takich okolicznościach mogą wystąpić istotne wahania stężenia procentowego.
Znaczenie gęstości roztworu w obliczeniach stężenia
Gęstość roztworu odgrywa kluczową rolę w obliczaniu stężenia procentowego, co jest szczególnie istotne, gdy przekształcamy masę składników na ich objętość. Ta wartość umożliwia zamianę objętości roztworu na masę, a tym samym precyzyjne ustalenie stężenia procentowego, zarówno masowego, jak i objętościowego.
Przykładowo, mając informację o gęstości roztworu, możemy szczegółowo określić, ile substancji rozpuszczonej znajduje się w stosunku do całkowitej masy lub objętości roztworu. Dodatkowo, w laboratoriach powszechnie wykorzystuje się gęstość różnych rozpuszczalników, takich jak:
- woda,
- etanol.
Dzięki temu, przy tworzeniu roztworów, możemy zapewnić odpowiednią precyzję obliczeń stężenia oraz właściwie przeliczać jednostki stosowane w procesach analizy chemicznej.
W jakich zadaniach i doświadczeniach chemicznych stosuje się obliczenia stężenia procentowego?
Obliczanie stężenia procentowego odgrywa istotną rolę w różnych zagadnieniach chemicznych, od testów w szkolnych klasach po praktyczne eksperymenty w laboratoriach. Ta umiejętność umożliwia tworzenie roztworów o dokładnie określonym stężeniu, co jest niezbędne do kontrolowania zachodzących procesów chemicznych. W laboratoriach chemicznych takie obliczenia wykorzystywane są szczególnie w analizie jakości substancji oraz podczas miareczkowania.
W przemyśle farmaceutycznym i spożywczym stężenie procentowe ma kluczowe znaczenie. Precyzyjne dozowanie składników gwarantuje nie tylko skuteczność, ale również bezpieczeństwo finalnych produktów. Z tego powodu umiejętność obliczania stężenia procentowego jest niezwykle przydatna zarówno dla studentów, jak i dla profesjonalistów w dziedzinie chemii analitycznej. Ta wiedza stanowi cenny element ich edukacji oraz praktycznej działalności w branży.