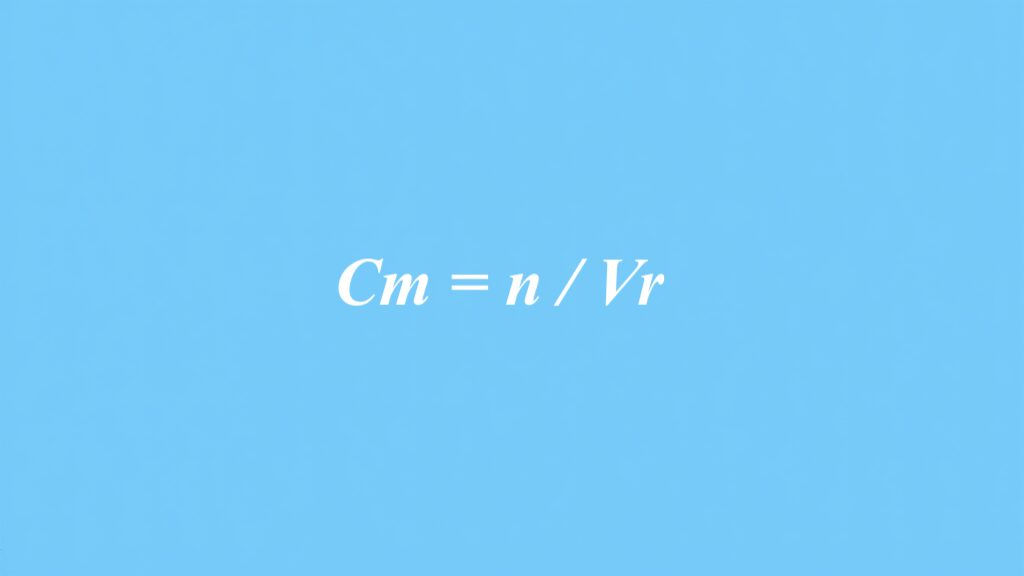Co to jest stężenie molowe?
Stężenie molowe to fundamentalna koncepcja w chemii, która definiuje liczbę moli substancji rozpuszczonej w jednym decymetrze sześciennym roztworu, czyli w 1 dm³. Można je wyrazić w jednostkach moli na litr (mol/dm³), co ułatwia wyobrażenie sobie ilości substancji w danym roztworze. Dzięki tej miarze chemicy mają możliwość precyzyjnego określenia składu roztworów, co jest niezbędne w wielu obszarach chemii, takich jak chemia analityczna czy ogólna.
Mól, kluczowe pojęcie w naukach przyrodniczych, definiuje ilość materii i odpowiada 6,022 × 10^23 cząstkom. To przeliczenie pomaga zrozumieć, ile atomów lub cząsteczek znajduje się w danym układzie, co z kolei pozwala chemikom na precyzyjne obliczenia stężeń różnych substancji. Tego typu wiedza ma znaczenie zarówno w laboratoriach, jak i w przemyśle chemicznym.
Stężenie molowe jest także narzędziem, które zapewnia standaryzację badań oraz reakcji chemicznych, co ułatwia porównywanie wyników i powtarzalność eksperymentów w różnych warunkach. Tę praktyczną wartość stężenia molowego można dostrzec w codziennej pracy chemików, którzy dzięki niemu mają do dyspozycji solidne podstawy do prowadzenia badań i syntez.
Jakie jest znaczenie wzoru na stężenie molowe?
wzór na stężenie molowe, przedstawiony jako Cm = n / V, odgrywa kluczową rolę w dziedzinie chemii. Pozwala on zarówno naukowcom, jak i studentom obliczać stężenie substancji rozpuszczonej w danym roztworze, co jest niezbędne do przeprowadzania precyzyjnych obliczeń chemicznych. Dzięki temu wzorowi przygotowanie roztworów o pożądanych stężeniach staje się prostsze, co ma ogromne znaczenie zarówno w laboratoriach, jak i w przemyśle chemicznym.
Stężenie molowe jest również fundamentem analizy reakcji chemicznych oraz stechiometrii. Umożliwia przewidywanie rezultatów reakcji, a także określenie wymaganych ilości reagentów. Zrozumienie tego wzoru sprzyja właściwej kontroli jednostek miary oraz pozwala na dokonywanie dokładnych pomiarów, co znacząco ogranicza ryzyko popełnienia błędów w obliczeniach.
Obliczanie stężenia molowego jest niezwykle pomocne przy:
- właściwym mieszaniu roztworów,
- ich rozcieńczaniu,
- co jest rutynową praktyką w wielu laboratoriach.
Dlatego tak istotne jest, aby osoby związane z chemią, niezależnie od tego, czy są w trakcie nauki, czy pracują w zawodzie, dokładnie rozumiały ten wzór.
Jak brzmi wzór na stężenie molowe?
Wzór na stężenie molowe odgrywa istotną rolę w chemii i przedstawia się go jako Cm = n / V. W tej formule Cm symbolizuje stężenie molowe, wyrażane w molach na decymetr sześcienny (mol/dm³). Liczba moli substancji rozpuszczonej, oznaczana literą „n”, jest z kolei dzielona przez „V”, które reprezentuje objętość roztworu, podaną w decymetrach sześciennych.
Głównym celem tego wzoru jest ustalenie proporcji między ilością moli a objętością roztworu. Dzięki temu można lepiej zrozumieć oraz precyzyjnie obliczyć stężenie substancji chemicznych w danym roztworze. Korzystając z powyższej formuły, chemicy mają możliwość określenia, ile moli konkretnego związku chemicznego znajduje się w określonej objętości.
W praktyce, dzięki wzorowi Cm = n / V, specjaliści są w stanie dokładnie przygotowywać roztwory o pożądanym stężeniu. To ma kluczowe znaczenie nie tylko w badaniach laboratoryjnych, ale również w zastosowaniach przemysłowych, gdzie precyzja jest niezwykle ważna.
Co oznaczają symbole we wzorze Cm = n / V?
Symbol Cm w równaniu Cm = n / V oznacza stężenie molowe, które wyrażane jest w molach na litr, czyli mol/dm³. Natomiast n to liczba moli substancji rozpuszczonej, którą możemy łatwo obliczyć, dzieląc masę substancji (m) przez jej masę molową (M), zapisując to jako n = m / M. Z kolei V symbolizuje objętość roztworu, mierzoną w decymetrach sześciennych (dm³).
Te symbole odgrywają fundamentalną rolę w precyzyjnych obliczeniach stężenia molowego. To pojęcie jest niezwykle ważne w chemii, ponieważ pozwala zrozumieć, jak substancje chemiczne zachowują się w roztworach. Dokładna analiza tych symboli oraz ich znaczenia w obliczeniach chemicznych przyczynia się do lepszego przygotowania roztworów w laboratoriach.
Jakie są jednostki stężenia molowego?
Jednostką stężenia molowego jest mol na litr, co możemy zapisać jako mol/dm³ lub mol/L. To powszechnie stosowany termin w chemii, który odnosi się do liczby moli substancji rozpuszczonej w jednym litrze roztworu.
Aby uzyskać bardziej precyzyjne wyniki, zwłaszcza w laboratoriach, wprowadza się także mniejsze jednostki, takie jak milimol na dm³ (mmol/dm³). Właściwe posługiwanie się jednostkami jest niezwykle istotne. Zapewnia to nie tylko poprawność obliczeń, ale także minimalizuje ryzyko błędów, które mogą pojawić się na skutek niewłaściwego przeliczenia.
Ścisła kontrola jednostek przy przeprowadzaniu obliczeń jest kluczowym aspektem w zachowaniu precyzji analiz chemicznych oraz w przygotowywaniu roztworów. Dzięki temu można uzyskiwać rzetelne wyniki oraz prowadzić wiarygodne eksperymenty.
Jak obliczyć stężenie molowe roztworu?
Aby obliczyć stężenie molowe roztworu, posługujemy się wzorem Cm = n / V. W tym równaniu Cm oznacza stężenie molowe, n to liczba moli substancji rozpuszczonej, a V to objętość roztworu wyrażona w dm³. Kluczowym elementem jest określenie liczby moli (n), co możemy uzyskać, dzieląc masę substancji (m) przez jej masę molową (M), co przedstawia wzór: n = m / M.
Na początku należy starannie zważyć masę substancji, którą chcemy rozpuścić. Później wyznaczamy objętość roztworu, która musi odpowiadać całkowitej objętości całej mieszaniny. To jest niezwykle ważne, ponieważ dokładne pomiary masy oraz objętości mają istotny wpływ na precyzję naszych obliczeń.
Dla przykładu, jeśli mamy 10 g NaCl, którego masa molowa wynosi około 58,44 g/mol, dokonujemy obliczenia liczby moli:
- n = 10 g / 58,44 g/mol ≈ 0,171 moli,
- jeśli zaś objętość roztworu wynosi 0,5 dm³,
- możemy obliczyć stężenie molowe:
- Cm = 0,171 mol / 0,5 dm³ = 0,342 mol/dm³.
Utrzymanie właściwych jednostek oraz dbanie o dokładność mierników to klucz do osiągnięcia prawidłowych wyników w obliczeniach stężenia molowego.
Jak uzyskać ilość moli substancji rozpuszczonej?
Aby obliczyć ilość moli rozpuszczonej substancji, można skorzystać z następującego wzoru:
n = m / M,
gdzie:
- n to liczba moli,
- m to masa substancji w gramach,
- M to masa molowa danej substancji wyrażona w gramach na mol (g/mol).
Na przykład, mając 10 gramów soli kuchennej (NaCl), a jej masa molowa wynosi 58,44 g/mol, możesz ustalić ilość moli, dzieląc 10 g przez 58,44 g/mol. W wyniku tych obliczeń otrzymasz około 0,171 moli.
Dokładne ważenie substancji oraz znajomość jej masy molowej są niezwykle istotne w chemii. Te informacje pozwalają precyzyjnie określić stężenie molowe roztworu, co jest kluczowe do przeprowadzania efektywnych eksperymentów.
Jak określić objętość roztworu?
Aby obliczyć objętość roztworu (V), użyjemy wzoru na stężenie molowe, który ma postać: V = n / Cm. W tym równaniu n oznacza liczbę moli rozpuszczonej substancji, a Cm to stężenie molowe. Objętość wyrażamy w decymetrach sześciennych (dm³), będących standardową jednostką w chemii.
Istnieje również możliwość bezpośredniego pomiaru objętości roztworu, korzystając z odpowiednich narzędzi, takich jak:
- cylinder miarowy,
- pipeta.
Warto pamiętać, że podczas przygotowywania roztworów należy uwzględnić zarówno objętość rozpuszczalnika, jak i masę substancji rozpuszczonej, ponieważ gęstość roztworu ma istotny wpływ na końcowe wyniki obliczeń.
Nie mniej istotna jest precyzja pomiaru objętości roztworu. Dokładność w tym zakresie pomoże uniknąć późniejszych błędów w obliczeniach związanych ze stężeniem molowym.
Przykładowe zadania z obliczaniem stężenia molowego
Przykładowe zadania dotyczące obliczania stężenia molowego stanowią ważny element nauki chemii, ułatwiając praktyczne zastosowanie wzoru Cm = n / V. Przyjrzyjmy się kilku przykładom, które pomogą lepiej zrozumieć tę tematykę.
Zacznijmy od pierwszego przykładu: obliczamy stężenie molowe NaOH. Mamy 4 gramy NaOH rozpuszczone w 0,5 litra wody. Najpierw ustalamy liczbę moli NaOH, wykorzystując masę molową, która wynosi około 40 g/mol. Wzór n = masa / masa molowa prowadzi do obliczenia:
- n = 4 g / 40 g/mol = 0,1 mola,
- Cm = n / V = 0,1 mol / 0,5 L = 0,2 mol/L.
Przechodzimy do kolejnego przykładu: obliczamy stężenie molowe H2SO4. Przyjmujemy, że mamy 9,8 grama H2SO4 rozpuszczone w 0,2 litra wody. Masa molowa H2SO4 wynosi około 98 g/mol, co pozwala nam na obliczenie liczby moli:
- n = 9,8 g / 98 g/mol = 0,1 mola,
- Cm = 0,1 mol / 0,2 L = 0,5 mol/L.
W ostatnim przykładzie zajmiemy się HCl. Załóżmy, że mamy 3,65 grama HCl rozpuszczone w 0,1 litra wody. Masa molowa HCl to około 36,5 g/mol, co prowadzi nas do obliczenia liczby moli:
- n = 3,65 g / 36,5 g/mol = 0,1 mola,
- Cm = 0,1 mol / 0,1 L = 1 mol/L.
Te przykłady ilustrują, jak przeliczać jednostki oraz przedstawiają popularne związki chemiczne, takie jak NaCl, NH4NO3 czy H3PO4. Ważne jest również, aby kontrolować wyniki oraz unikać błędów w obliczeniach, co jest kluczowe dla uzyskania dokładnych rezultatów w chemii.
Kiedy stosować stężenie molowe w chemii?
Stężenie molowe, znane jako Cm, to niezwykle istotny termin w chemii, który znajduje szerokie zastosowanie w wielu kontekstach. W szczególności, w analizie chemicznej, gdzie od precyzyjnych ilości substancji zależy uzyskanie rzetelnych wyników. Dzięki stężeniu molowemu możliwe jest dokładne przygotowywanie roztworów, co jest absolutnie kluczowe w pracy laboratoryjnej.
Kiedy więc stężenie molowe staje się naprawdę istotne? Przede wszystkim w chemii analitycznej, gdzie kontrola stężenia reagentów odgrywa kluczową rolę w minimalizowaniu błędów pomiarowych. Ponadto, ma ono ogromne znaczenie w obliczeniach stechiometrycznych, pozwalając na przewidywanie przebiegu reakcji chemicznych oraz prawidłowe wyważanie ich równań. Taki precyzyjny dostęp do informacji umożliwia obliczenie potrzebnych ilości reagentów, aby uzyskać zamierzony efekt.
W przemyśle chemicznym stężenie molowe wspomaga doskonalenie procesów, takich jak:
- synteza chemiczna,
- kontrola jakości,
- elastyczne dostosowywanie proporcji reagentów,
- zwiększenie efektywności,
- obniżenie kosztów.
Kiedy przygotowujemy roztwory, wykorzystanie stężenia molowego pozwala osiągnąć pożądane właściwości fizykochemiczne, co jest kluczowe dla uzyskania stabilnych i powtarzalnych rezultatów w eksperymentach. Ponadto, stężenie molowe jest podstawą przy obliczeniach związanych z rozcieńczaniem roztworów, gdzie precyzyjne określenie liczby moli ma ogromne znaczenie.
Warto więc zauważyć, że stężenie molowe nie stanowi jedynie narzędzia do klasyfikacji roztworów, ale jest fundamentalnym elementem w praktycznych zastosowaniach chemii w laboratoriach oraz w przemyśle.
Stężenie molowe a inne rodzaje stężeń
Stężenie molowe to kluczowy sposób na określenie ilości substancji w roztworze i różni się od innych metod, takich jak:
- stężenie procentowe, które odnosi się do udziału masy substancji w całkowitej masie roztworu,
- stężenie molalne, które koncentruje się na liczbie moli substancji rozpuszczonej w jednym kilogramie rozpuszczalnika,
- stężenie formalne, które uwzględnia substancje dysocjujące.
Stężenie procentowe oznacza, że w 100 g roztworu znajduje się 10 g danej substancji. Aby zamienić stężenie procentowe na stężenie molowe, potrzebujemy informacji o masie molowej substancji oraz gęstości roztworu.
Stężenie molalne zapewnia większą precyzję w chemii, szczególnie gdy temperatura wpływa na objętość roztworu.
Stężenie formalne jest istotnym parametrem w analizach chemicznych, ponieważ nie wszystkie cząsteczki rozpuszczonego związku przekształcają się w jony.
Zrozumienie różnic pomiędzy tymi rodzajami stężeń oraz umiejętność ich przeliczania są niezbędne w pracy laboratoryjnej. Ta wiedza ma zastosowanie w dziedzinach takich jak farmakologia czy biotechnologia, co pozwala na przeprowadzanie dokładniejszych eksperymentów chemicznych oraz bardziej efektywne obliczenia stechiometryczne.
Jak przeliczyć stężenie procentowe na stężenie molowe?
Aby przekształcić stężenie procentowe na stężenie molowe, możesz skorzystać z następującego wzoru:
Cm = (Cp * dr) / (M * 100%)
Gdzie:
- Cm to stężenie molowe,
- Cp oznacza stężenie procentowe,
- dr to gęstość roztworu wyrażona w g/dm³,
- M to masa molowa substancji w jednostkach g/mol.
Przykładowo, jeśli mamy stężenie procentowe na poziomie 10%, gęstość roztworu wynosi 1,1 g/dm³, a masa molowa substancji to 58,44 g/mol, obliczenia będą wyglądały następująco:
Cm = (10 * 1,1) / (58,44 * 100) = 0,00188 mol/dm³.
W tej formule gęstość roztworu odgrywa istotną rolę. Umożliwia ona przeliczenie masy substancji na objętość roztworu, co jest kluczowe dla uzyskania precyzyjnych wyników.
Dzięki temu prostemu wzorowi zamiana stężenia procentowego na stężenie molowe staje się łatwiejsza. Ma to znaczenie w różnorodnych zastosowaniach chemicznych, takich jak obliczenia stechiometryczne czy w przygotowywaniu roztworów w laboratoriach.
Stężenie molalne a stężenie molowe
Stężenie molalne i stężenie molowe to dwa kluczowe pojęcia w chemii, które różnią się zarówno znaczeniem, jak i zastosowaniem.
Stężenie molalne, znane również jako molalność, odnosi się do liczby moli substancji rozpuszczonej w kilogramie rozpuszczalnika. Co istotne, ta wartość pozostaje stała, niezależnie od zmian temperatury i ciśnienia, ponieważ dotyczy masy rozpuszczalnika, a nie objętości roztworu.
Stężenie molowe, określane jako molowość, definiuje się jako liczbę moli substancji rozpuszczonej w litrze roztworu. W przeciwieństwie do molalności, to stężenie jest wrażliwe na zmiany temperatury i ciśnienia, co może wpływać na objętość roztworu.
W praktycznych zastosowaniach, molalność często znajduje swoje miejsce w reakcjach, gdzie zmiany temperatury mogą wpływać na wielkość objętości roztworu. Natomiast molowość jest szeroko stosowana w obliczeniach stechiometrycznych, gdzie kluczowe jest uwzględnienie ilości substancji chemicznej w danej objętości.
Decyzja o wyborze między stężeniem molalnym a molowym zależy od konkretnego kontekstu oraz wymagań dotyczących precyzji obliczeń chemicznych. Również okoliczności, w jakich roztwór będzie używany, mają duże znaczenie.
Stężenie formalne i formalność
Stężenie formalne, znane również jako formalność, odgrywa kluczową rolę w chemii, szczególnie w kontekście roztworów elektrolitów. Definiuje się je jako liczbę moli formułowych substancji rozpuszczonej w jednym litrze roztworu. Pojęcie to ma duże znaczenie w przypadku związków, które ulegają dysocjacji w wodzie, jak na przykład sole, kwasy i zasady, które rozdzielają się na jony.
W porównaniu do stężenia molowego, które odnosi się do całkowitej liczby moli substancji w roztworze, formalność koncentruje się wyłącznie na molach formułowych. Warto zauważyć, że formalność ignoruje zjawisko dysocjacji, co sprawia, że obliczenia tego stężenia są nieocenione dla dokładnego oszacowania ilości dostępnych jonów. Na przykład, roztwór NaCl o formalności 1 M oferuje jony Na⁺ i Cl⁻, co ma kluczowe znaczenie dla przeprowadzania reakcji chemicznych.
Formalność jest szczególnie istotna w chemii analitycznej oraz fizycznej, gdzie precyzyjne obliczenia i zrozumienie zachowań elektrolitów są ekstremalnie ważne. Wykorzystanie stężenia formalnego umożliwia chemikom dokładniejsze przewidywanie właściwości oraz reakcji zachodzących w roztworach. Co więcej, przyczynia się do spójności obliczeń z charakterystyką fizykochemiczną tych substancji.
Najczęstsze błędy przy stosowaniu wzoru na stężenie molowe
Najczęstsze problemy przy obliczaniu stężenia molowego często wynikają z:
- niepoprawnego przeliczania jednostek,
- trudności w precyzyjnym pomiarze,
- niedbałości w zakresie gęstości roztworu.
Wiele osób, które zajmują się tymi obliczeniami, nie zwraca uwagi na gęstość roztworu, co może znacząco wpłynąć na wyniki. Niezrozumienie jednostek prowadzi do błędnych wartości zarówno moli, jak i objętości, a to z kolei wpływa na końcowe rezultaty.
Innym powodem pojawiania się błędów są:
- niedokładne pomiary masy substancji,
- niedokładne pomiary objętości roztworu,
- zmiany objętości roztworu w zależności od temperatury i ciśnienia.
Odpowiednie wymieszanie roztworów jest kluczowe, ponieważ nierównomierne mieszanki mogą wprowadzać w błąd przy ustalaniu właściwego stężenia molowego.
Dbanie o właściwe jednostki jest podstawą każdej analizy chemicznej. Konieczne jest, by wszystkie wartości były podawane w spójnych jednostkach, co znacznie ułatwia przeliczenia i interpretację wyników.
Unikanie tych błędów przy obliczeniach stężenia molowego przekłada się na bardziej dokładne i godne zaufania wyniki, co ma ogromne znaczenie w praktyce chemicznej.
Problemy z jednostkami i precyzją pomiarów
Problemy związane z jednostkami oraz dokładnością pomiarów odgrywają niezwykle istotną rolę w procesie wyliczania stężenia molowego. Często zdarza się, że mylimy jednostki, takie jak mol/dm³, z innymi typami miar stężenia. To dość powszechny błąd, który może prowadzić do nieprawidłowych wyników. Z tego powodu niezwykle ważne jest, aby dokładnie kontrolować używane jednostki w czasie obliczeń.
Aby uzyskać precyzyjne rezultaty, kluczowe są:
- dokładne pomiary masy substancji,
- preczyzyjne pomiary objętości roztworu.
- niewielkie niedociągnięcia przy ważeniu lub w pomiarze objętości.
Już niewielkie błędy mogą znacząco wpłynąć na obliczone stężenie molowe. W efekcie mogą pojawić się błędy, które wpłyną na wyniki eksperymentów oraz analiz chemicznych.
Podczas obliczania stężenia molowego każdy błąd dotyczący jednostek lub pomiarów może prowadzić do mylnych interpretacji. Dlatego tak ważne jest korzystanie z:
- właściwych narzędzi pomiarowych,
- technik laboratoryjnych,
- udzielającej pomocy zredukowania ryzyka pomyłek.
Uważne podejście do pomiarów i obliczeń jest kluczowe dla osiągnięcia sukcesów w badaniach chemicznych.
Wpływ gęstości roztworu na obliczenia
Wpływ gęstości roztworu na prowadzone obliczenia w chemii jest niezwykle istotny, szczególnie podczas przeliczania stężenia procentowego na stężenia molowe. Gęstość, wyrażana w g/dm³, dostarcza kluczowych informacji, które są potrzebne do dokładnych wyliczeń. Zaniedbanie tego aspektu może prowadzić do poważnych błędów, co staje się problematyczne, gdy w obliczeniach korzystamy z masy i objętości rozpuszczalnika.
Podczas przeliczania stężenia należy bezwzględnie uwzględniać gęstość, ponieważ:
- różne roztwory o tej samej masie mogą mieć odmienne objętości,
- gęstość różnych rozpuszczalników wpływa na obliczenia dotyczące stężenia molowego,
- ważne jest, aby najpierw poznać gęstość roztworu, a następnie wkomponować ją w odpowiednie wzory obliczeniowe.
Dodatkowo, gęstość odgrywa ważną rolę przy przygotowywaniu roztworów oraz w kontroli ich właściwości fizycznych. Dokładne uwzględnienie tego parametru wpływa na precyzję wyników laboratoryjnych oraz na przebieg reakcji chemicznych, co w efekcie prowadzi do uzyskania lepszej jakości danych.
Gdzie wykorzystuje się wzór na stężenie molowe?
Wzór na stężenie molowe stanowi niezwykle cenne narzędzie w wielu dziedzinach nauki i przemysłu. W laboratoriach głównie wykorzystuje się go do sporządzania roztworów, gdzie dokładne określenie stężenia jest niezwykle istotne dla przeprowadzania eksperymentów oraz analizy wyników.
W sektorze chemicznym jego znaczenie jest również duże. Pozwala on na monitorowanie procesów produkcji, udoskonalanie receptur oraz gwarantowanie wysokiej jakości wyrobów. Ale to nie koniec jego zastosowań.
W chemii analitycznej wzór ten umożliwia precyzyjne identyfikowanie składników roztworów. Dzięki obliczeniom stechiometrycznym chemicy są w stanie przewidzieć ilości reagentów potrzebnych do przeprowadzania reakcji, co jest niezbędne w takich operacjach jak:
- synteza chemiczna,
- analiza jakościowa,
- analiza ilościowa substancji.
Dodatkowo, stosując ten wzór, można przeprowadzać analizy porównawcze różnych roztworów chemicznych. Takie badania mają kluczowe znaczenie w nauce oraz w przemyśle, gdzie stabilność i stałość składników mogą zdecydować o jakości końcowego produktu.
Przygotowywanie roztworów w laboratorium
Przygotowywanie roztworów w laboratorium polega na tworzeniu substancji o określonym stężeniu molowym. Cały proces wymaga wyjątkowej precyzji w pomiarach zarówno masy substancji, jak i objętości rozpuszczalnika. Kluczowym etapem jest odpowiednie odważenie materiału, który następnie należy rozpuścić w wodzie lub innym odpowiednim rozpuszczalniku.
Aby uzyskać roztwór o pożądanym stężeniu, ważne jest, aby właściwie kontrolować jednostki miary. Na przykład:
- masę rozpuszczonej substancji należy wyrażać w gramach,
- objętość roztworu w litrach.
Dokładność pomiarów jest niezwykle istotna, ponieważ nawet najmniejsze błędy mogą prowadzić do niewłaściwych wyników stężenia, co z kolei wpływa na rezultaty przeprowadzanych eksperymentów.
W laboratorium proces ten rozpocznij od zważenia substancji na wadze laboratoryjnej, co pozwala uzyskać precyzyjny wynik. Następnie umieszcza się ją w odpowiednim naczyniu i dodaje właściwą ilość wody, aby uzyskać żądaną objętość roztworu.
Korzystając z równania na stężenie molowe, czyli Cm = n / V, można szybko obliczyć potrzebne stężenie. To cenne narzędzie jest nieodzowne w wielu eksperymentach chemicznych. Dzięki tym metodom laboratoria mogą osiągać rzetelne i powtarzalne wyniki swoich badań.
Obliczenia stechiometryczne reakcji chemicznych
Obliczenia stechiometryczne w reakcjach chemicznych opierają się na kluczowej koncepcji stężenia molowego, które jest wyrażane w molach na litr (mol/L). Ta miara umożliwia precyzyjne ustalenie ilości reagentów biorących udział w danej reakcji. Znajomość stężenia molowego roztworów chemicznych pozwala chemikom obliczać liczbę moli substancji, co jest niezwykle istotne dla zachowania właściwych proporcji podczas reakcji.
Dzięki stężeniu molowemu chemicy potrafią przewidzieć przebieg reakcji, co z kolei sprzyja skutecznemu planowaniu eksperymentów zarówno w chemii analitycznej, jak i syntezie. Umiejętność prawidłowego stosowania tych obliczeń stanowi fundament pracy w laboratoriach, gdzie różne stężenia reagentów są standardowo wykorzystywane do osiągania oczekiwanych rezultatów.
Ponadto stężenie molowe wpływa na obliczenia różnych parametrów eksperymentalnych, takich jak:
- objętości,
- ilości reagujących substancji,
- dokładność wyników.
Staranna aplikacja wzoru na stężenie molowe jest kluczowa, aby zredukować ryzyko błędów, które mogłyby negatywnie wpłynąć na dokładność wyników.
Jak poprawnie stosować wzór na stężenie molowe w praktyce?
Poprawne posługiwanie się wzorem na stężenie molowe wymaga kilku istotnych kroków. Przede wszystkim trzeba precyzyjnie określić masę substancji, którą rozpuszczasz. Zastosowanie dokładnej wagi laboratoryjnej jest kluczowe, aby uniknąć pomyłek związanych z błędnym pomiarem masy.
Następnym krokiem jest wybór odpowiedniego rozpuszczalnika. Na przykład:
- woda,
- alkohol,
- inna ciecz.
Równie ważne jest precyzyjne zmierzenie objętości roztworu. Używając menzur, pipet lub cylinderków miarowych, zapewniasz dokładność pomiarów, co jest niezbędne dla uzyskania stosownego stężenia.
Nie mniej istotna jest kontrola jednostek miar. Upewnij się, że:
- masa substancji jest w gramach,
- objętość roztworu jest w litrach.
Dodatkowo, ważne jest skrupulatne mieszanie roztworów. Starannie przygotowana mieszanka zapobiega nierównomiernemu stężeniu, co jest kluczowe w kontekście przyszłych zastosowań naukowych oraz przemysłowych.
Regularne monitorowanie wyników jest także nieodzowne, aby w porę wychwycić ewentualne nieprawidłowości. Utrzymanie wysokiej precyzji podczas przygotowywania roztworów i obliczania stężenia molowego jest niezbędne dla pewności wyników oraz ich użyteczności w chemii.
Jak dobrać rozpuszczalnik i masę substancji?
Wybór odpowiedniego rozpuszczalnika, którym zazwyczaj jest woda, ma fundamentalne znaczenie podczas tworzenia roztworów. O tej decyzji decydujemy w oparciu o:
- rozpuszczalność danej substancji,
- cel, któremu ma służyć przygotowywany roztwór.
Dobrze dobrany rozpuszczalnik gwarantuje, że substancja rozpuszczona osiągnie pożądane cechy, co ma istotny wpływ na nasze wyniki eksperymentów.
Masa substancji, którą chcemy rozpuścić, również odgrywa kluczową rolę w obliczaniu stężenia molowego. Musi być ona dokładnie odważona, co można osiągnąć przy użyciu wagi analitycznej, pozwalającej na precyzyjne pomiary. Z istotnych parametrów:
- masa molowa substancji umożliwia określenie liczby moli,
- aby uzyskać roztwór o konkretnym stężeniu molowym, należy odważyć odpowiednią ilość substancji,
- przestrzegając w tym procesie wszystkich zasad precyzyjnej pracy laboratoryjnej.
Zarówno precyzyjne odważanie, jak i mądry dobór rozpuszczalnika są kluczowe dla uzyskania spójnych i wiarygodnych wyników. Przygotowywanie roztworów w laboratorium wymaga staranności oraz znajomości właściwości substancji, które są rozpuszczane. Tylko w takich warunkach możemy przeprowadzać szczegółowe analizy i badania, utrzymując wysokie standardy jakości.
Jak kontrolować poprawność obliczeń?
Kontrola poprawności obliczeń jest niezwykle istotna w pracy chemika, zwłaszcza w kontekście obliczania stężeń molowych. Aby uzyskać precyzyjne wyniki, należy pamiętać o kilku kluczowych zasadach:
- w jednostkach używanych w obliczeniach liczba moli (n) musi być wyrażona w molach, a objętość (V) w litrach,
- korzystanie z wysokiej klasy narzędzi pomiarowych, takich jak wagi analityczne, znacząco zmniejsza ryzyko pomyłek,
- regularne kalibracje sprzętu oraz właściwe stosowanie cylindrów miarowych są podstawą precyzyjnych pomiarów,
- należy upewnić się, że stosowane równania są poprawne,
- dokładne informacje na temat gęstości mogą znacząco wpłynąć na wyniki.
Staranna kontrola wzorów oraz przeliczeń oraz uwzględnienie gęstości roztworu przy przeliczaniu stężeń procentowych, przyczyniają się znacząco do podniesienia jakości i wiarygodności wyników w dziedzinie chemii.