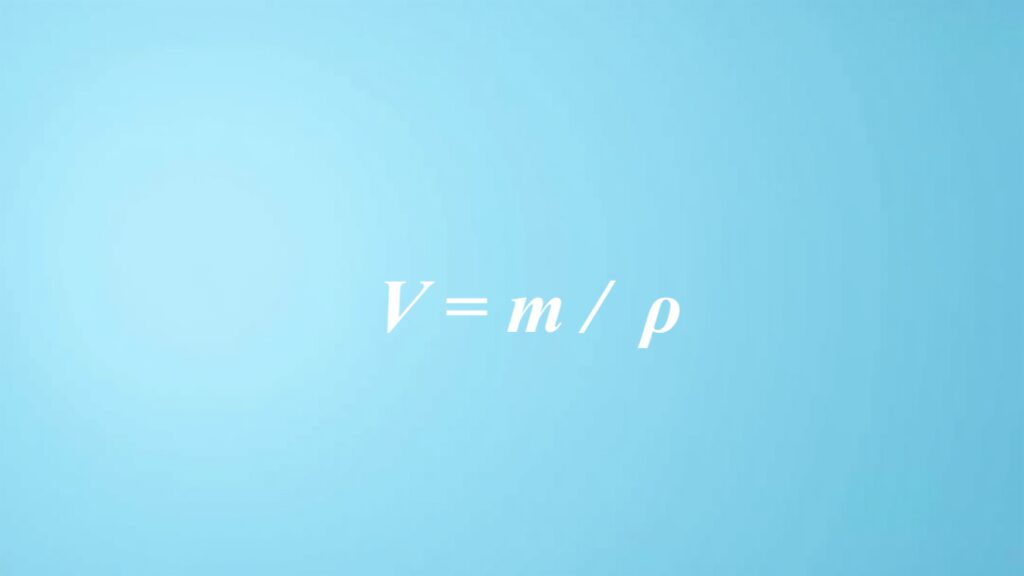Czym jest wzór na objętość w chemii?
Wzór na objętość w chemii to istotna formuła, która pozwala na określenie objętości substancji, bazując na kluczowych parametrach, takich jak masa i gęstość, lub liczba moli w połączeniu ze stężeniem molowym. Przykłady zastosowania można znaleźć we wszystkich stanach skupienia: od ciał stałych, przez ciecze, aż po gazy.
Dla substancji stałych wykorzystujemy równanie V = m / d, gdzie m to masa, a d oznacza gęstość. Z kolei w przypadku cieczy oraz gazów, stosowany jest wzór V = n / Cm, w którym n reprezentuje liczbę moli, a Cm to stężenie molowe.
Dokonywanie obliczeń objętości ma kluczowe znaczenie zarówno w laboratoriach chemicznych, jak i w naukach przyrodniczych oraz inżynierii. Dokładne określenie przestrzeni zajmowanej przez substancje jest niezwykle ważne, ponieważ wpływa na zrozumienie ich zachowania w reakcjach chemicznych oraz w procesach technologicznych. Zrozumienie tych wzorów nie tylko ułatwia analizę roztworów, ale także wspiera efektywne planowanie eksperymentów, co przekłada się na precyzyjniejsze wyniki w badaniach chemicznych.
Jakie są podstawowe wzory na objętość stosowane w chemii?
Podstawowe wzory służące do obliczania objętości w chemii są kluczowe w pracy z różnorodnymi substancjami, zarówno stałymi, jak i ciekłymi czy gazowymi. Najważniejszy z nich to V = m / d, gdzie V oznacza objętość, m to masa danej substancji, a d przedstawia jej gęstość. Dzięki temu równaniu szybkie obliczenie objętości staje się znacznie łatwiejsze i jest niezwykle pomocne w laboratoriach chemicznych.
Inny ważny wzór to V = n / Cm. W tym przypadku V odnosi się do objętości roztworu, n to liczba moli substancji rozpuszczonej, a Cm oznacza stężenie molowe roztworu. Umożliwia to precyzyjne wyznaczenie ilości moli substancji w określonej objętości roztworu, co jest niezbędne podczas przygotowywania roztworów oraz w trakcie przeprowadzania reakcji chemicznych.
Gdy chodzi o substancje stałe, które mają regularne kształty, wykorzystuje się różnorodne wzory geometryczne. Oto kilka przykładów:
- Prostopadłościan: V = a * b * h (gdzie a, b oraz h to długości krawędzi),
- Walec: V = π * r² * h (gdzie r to promień podstawy, a h to wysokość),
- Kula: V = (4/3) * π * r³ (gdzie r to promień kuli),
- Stożek: V = (1/3) * π * r² * h (gdzie r to promień podstawy, a h to wysokość),
- Ostrosłup: V = (1/3) * B * h (gdzie B oznacza pole podstawy, a h to wysokość).
Te wzory pozwalają dokładnie obliczać objętości obiektów o zdefiniowanych kształtach. Dzięki nim chemicy mogą precyzyjnie przygotowywać eksperymenty i analizować uzyskane wyniki.
Wzór: V = m / d (masa i gęstość)
Wzór V = m / d to fundamentalne równanie w chemii i fizyce, które służy do obliczania objętości substancji. W tym przypadku V oznacza objętość, m to masa, a d to gęstość. Gęstość, definiowana jako ilość masy w jednostce objętości, jest mierzona w kilogramach na metr sześcienny (kg/m³) lub gramach na centymetr sześcienny (g/cm³).
Aby określić objętość, wystarczy podzielić masę substancji przez jej gęstość. Na przykład, w sytuacji, gdy:
- masa wynosi 200 g,
- a gęstość to 2 g/cm³,
obliczenia przeprowadza się w prosty sposób:
V = 200 g / 2 g/cm³ = 100 cm³.
Ten wzór jest niezwykle przydatny, zwłaszcza w kontekście ciał stałych i cieczy, ponieważ masa oraz gęstość są parametrami, które można łatwo zmierzyć. W laboratoriach chemicznych znajomość wzoru V = m / d jest kluczowa dla przeprowadzania szybkich i precyzyjnych obliczeń związanych z objętością, co ma ogromne znaczenie w analizie substancji oraz w trakcie eksperymentów.
Co więcej, zrozumienie tego wzoru może pomóc w lepszym pojęciu właściwości fizycznych materiałów. Dzięki znajomości gęstości można przewidywać, jak substancje będą się zachowywać w różnych warunkach. Te informacje są niezwykle istotne w dziedzinach takich jak:
- chemia,
- inżynieria,
- nauki przyrodnicze.
Wzór: V = n / Cm (liczba moli i stężenie molowe)
Wzór V = n / Cm to niezwykle przydatne narzędzie w dziedzinie chemii, które służy do wyznaczania objętości roztworów. W tej formule V oznacza objętość roztworu, n to liczba moli substancji rozpuszczonej, a Cm reprezentuje stężenie molowe. Właśnie stężenie molowe wskazuje, ile moli substancji znajduje się w jednostce objętości roztworu.
Aby skutecznie zastosować ten wzór w praktyce, niezbędna jest znajomość zarówno stężenia molowego, jak i liczby moli substancji. Na przykład:
- gdy stężenie molowe roztworu wynosi 1 mol/dm³,
- a celem jest uzyskanie dwóch moli substancji,
- wystarczy podstawić dane do wzoru: V = 2 mole / 1 mol/dm³.
- Wynik to 2 dm³ roztworu.
Pojęcie przedstawione w formule V = n / Cm jest niezwykle istotne w kontekście analiz roztworów oraz przeprowadzania eksperymentów chemicznych. Dokładne przygotowanie roztworów o określonym stężeniu wpływa na przebieg reakcji oraz na dokładność obliczeń stechiometrycznych. Chemicy często muszą dbać o precyzyjne stężenia molowe, ponieważ mają one kluczowe znaczenie dla wyników doświadczeń laboratoryjnych.
Wzory geometryczne: prostopadłościan, walec, kula, stożek, ostrosłup
Obliczanie objętości ciał stałych odgrywa istotną rolę w chemii i fizyce. Kluczowe jest dobrze zrozumieć odpowiednie wzory, by przeprowadzać precyzyjne pomiary.
- Prostopadłościan charakteryzuje się prostym kształtem. Aby obliczyć jego objętość, wystarczy pomnożyć długość (a), szerokość (b) oraz wysokość (c). Wzór w tym przypadku to: V = a * b * c,
- Walec, z kolei, ma objętość uzależnioną od pola jego podstawy. Obliczamy ją, mnożąc pole koła (πr²) przez wysokość (h), co daje nam wzór: V = πr² * h,
- Kula to figura bardziej skomplikowana. Jej objętość wyliczamy za pomocą wzoru: V = 4/3 πr³, gdzie r oznacza promień kuli,
- Stożek, mający okrągłą podstawę, również może być łatwo obliczony. Jego objętość wyraża się jako 1/3 pola podstawy pomnożonego przez wysokość (h): V = 1/3 * πr² * h,
- Ostrosłup, który jest kolejnym rodzajem wielościanu, korzysta z podobnego wyrażenia. Jego objętość również wynosi 1/3, mnożone przez pole podstawy (B) i wysokość (h): V = 1/3 * B * h.
Zrozumienie tych wzorów geometrycznych jest niezwykle ważne dla skutecznego obliczania objętości przeróżnych figur. Takie obliczenia są niezbędne w laboratoriach chemicznych oraz podczas przeprowadzania eksperymentów. Dzięki nim chemicy mają możliwość precyzyjnego określania ilości substancji, co znacząco wpływa na wyniki badań.
Jak obliczyć objętość gazów w chemii?
Obliczanie objętości gazów w chemii wymaga znajomości kilku kluczowych zasad fizycznych. Niezastąpionym narzędziem w tym zakresie jest równanie stanu gazu idealnego, które przedstawia się jako PV = nRT. W tej formule:
- P oznacza ciśnienie,
- V to objętość,
- n to liczba moli,
- R to stała gazowa,
- T to temperatura wyrażona w kelwinach.
W standardowych warunkach mówimy o temperaturze wynoszącej 273,15 K oraz ciśnieniu równym 1 atm. W takich okolicznościach molowa objętość gazów wynosi około 22,4 dm³/mol.
Warto również znać wiodące prawa gazów, które pomagają wyjaśnić, jak zmieniają się ciśnienie i objętość w odpowiedzi na zmiany temperatury. Przykłady to:
- Prawo Boyle’a, które wskazuje, że przy stałej temperaturze objętość gazu jest odwrotnie proporcjonalna do jego ciśnienia,
- Prawo Charles’a, stwierdzające, że objętość gazu rośnie wprost proporcjonalnie do jego temperatury,
- Prawo Gay-Lussaca, które łączy zmiany ciśnienia z temperaturą, zakładając stałą objętość.
Aby skutecznie obliczyć objętość gazu w danym środowisku, ważne jest uwzględnienie tych zasad oraz założeń gazu idealnego. Jest to niezwykle istotne w prowadzeniu dokładnych eksperymentów chemicznych.
Równanie stanu gazu idealnego: PV = nRT
Równanie stanu gazu idealnego, znane jako równanie Clapeyrona, jest podstawowym wzorem w chemii, wyrażanym jako PV = nRT. W tej formule:
- P odnosi się do ciśnienia gazu,
- V to objętość, jaką gaz zajmuje,
- n oznacza liczbę moli substancji,
- R to stała gazowa, odpowiadająca wartości 8.314 J/(mol·K),
- T określa temperaturę w kelwinach.
To równanie stanowi kluczowy element w analizie zachowania gazów. Umożliwia obliczenie objętości danego gazu w zależności od ciśnienia i temperatury. Na przykład, jeden mol doskonałego gazu w standardowych warunkach (tj. 0°C i 1 atm) zajmuje przestrzeń o objętości 22,4 dm³.
Zastosowanie równania Clapeyrona jest niezwykle szerokie. Znajduje ono swoje miejsce w laboratoriach chemicznych, w inżynierii oraz podczas obliczeń dotyczących reakcji chemicznych, w których zachowanie gazów jest kluczowe. Niemniej jednak warto mieć na uwadze, że rzeczywiste gazy często nie zachowują się idealnie, co wymaga modyfikacji tego równania o uwzględnienie rzeczywistych warunków.
Objętość molowa gazów: 22,4 dm³/mol
Objętość molowa gazów wynosząca 22,4 dm³/mol oznacza, że jeden mol gazu zajmuje 22,4 decymetra sześciennego w standardowych warunkach, czyli przy temperaturze 0°C i ciśnieniu 1 atm. To kluczowy parametr w chemii, mający istotne znaczenie w różnych reakcjach oraz obliczeniach stechiometrycznych.
Prawo Avogadra stwierdza, że w równych objętościach różnych gazów, poddanych takim samym warunkom temperaturowym i ciśnieniowym, liczba cząsteczek pozostaje ta sama. Dzięki temu chemicy mogą przewidywać ilości gazów zaangażowanych w reakcje chemiczne, co jest niezwykle istotne w kontekście obliczeń związanych z reakcjami gazowymi.
Równanie Clapeyrona, które jest rozszerzeniem równania stanu gazu idealnego, umożliwia obliczanie właściwości gazów, uwzględniając ich objętość, ciśnienie oraz temperaturę. Wiedza o objętości molowej gazów jest niezbędna podczas przeprowadzania eksperymentów w laboratoriach chemicznych oraz analizy wyników. Zrozumienie i odpowiednie zastosowanie tego parametru przyczynia się do dokładniejszych i bardziej przewidywalnych wyników w badaniach chemicznych.
Prawo Boyle’a, prawo Charles’a, prawo Gay-Lussaca
Prawo Boyle’a, prawo Charles’a i prawo Gay-Lussaca to fundamentalne zasady, które pomagają nam zrozumieć, jak zachowują się gazy.
Prawo Boyle’a mówi, że przy stałej temperaturze, gdy ciśnienie gazu rośnie, jego objętość maleje. Można to wyrazić równaniem: P1V1 = P2V2, gdzie P to ciśnienie, a V to objętość. Innymi słowy, zwiększając ciśnienie, zmniejszamy objętość tego gazu.
Prawo Charles’a wskazuje, że przy stałym ciśnieniu objętość gazu rośnie wraz ze wzrostem jego temperatury wyrażonej w kelwinach. Związek ten można zapisać w postaci wzoru: V1/T1 = V2/T2, co oznacza, że wyższa temperatura skutkuje większą objętością.
Prawo Gay-Lussaca bada relację pomiędzy ciśnieniem a temperaturą gazu przy stałej objętości. Stwierdza, że gdy temperatura gazu się zwiększa, jego ciśnienie również wzrasta, co można zilustrować równaniem: P1/T1 = P2/T2.
Te trzy zasady są również powiązane z równaniem Clapeyrona, które kompleksowo łączy ciśnienie, objętość i temperaturę gazów. Zrozumienie tych interakcji jest niezbędne do dokładnych obliczeń objętości gazów w różnych warunkach, zarówno w atmosferze, jak i w warunkach laboratoryjnych.
Jak zmierzyć objętość cieczy i substancji stałych?
Pomiary objętości cieczy oraz substancji stałych można przeprowadzać na różne sposoby, zarówno w laboratoriach, jak i w codziennym życiu. Najpopularniejszą metodą jest pomiar bezpośredni z wykorzystaniem narzędzi laboratoryjnych, takich jak:
- cylinder miarowy,
- pipeta,
- biureta.
Cylinder miarowy umożliwia szybkie i precyzyjne odczyty, natomiast pipeta i biureta są idealne do dokładnego dozowania mniejszych ilości.
Gdy mówimy o substancjach stałych, kluczowe staje się ich kształt. Dla obiektów o regularnych formach korzystamy ze wzorów geometrycznych, takich jak:
- wzór na objętość prostopadłościanu,
- wzór na objętość walca.
Z kolei w przypadku ciał o nieregularnych kształtach pomocna jest metoda wyporu, opierająca się na prawie Archimedesa. Zgodnie z tym prawem, zanurzenie przedmiotu w cieczy prowadzi do wypierania objętości płynu odpowiadającej objętości przedmiotu. Dzięki temu możemy dokładnie określić objętość nieregularnych substancji stałych.
W nowoczesnych pomiarach objętości coraz częściej wykorzystuje się czujniki ultradźwiękowe, które umożliwiają bezkontaktowe pomiary, co jest niezwykle wygodne. Oprócz tego, gazometry pozwalają na pomiar objętości gazów. Tego typu innowacje są niezwykle cenne w laboratoriach, gdzie precyzyjne pomiary mają ogromne znaczenie.
Dokładność w pomiarze objętości w chemii odgrywa kluczową rolę, ponieważ wpływa na wyniki eksperymentów oraz analizy roztworów. Dlatego bardzo istotne jest, aby dobrać odpowiednią metodę pomiaru w zależności od rodzaju substancji, którą zamierzamy zbadać.
Pomiar bezpośredni: cylinder miarowy, pipeta, biureta
Pomiar objętości cieczy w laboratoriach chemicznych odgrywa kluczową rolę. W tym procesie niezbędne są narzędzia takie jak:
- cylinder miarowy,
- pipeta,
- biureta.
Cylinder miarowy, dzięki swojej prostej konstrukcji, doskonale sprawdza się w szybkim pomiarze większych ilości cieczy. Jego zaokrąglony kształt ułatwia precyzyjne odczyty menisku, co jest bardzo pomocne w codziennej pracy.
Pipeta natomiast pozwala na niezwykle dokładne pobieranie niewielkich objętości cieczy. Jej wysoka precyzja jest istotna zwłaszcza w eksperymentach, gdzie liczy się każdy mililitr reagentu.
Biureta to instrument, który umożliwia precyzyjne dozowanie cieczy, co ma szczególne znaczenie podczas titracji. Dzięki możliwości kontrolowania przepływu, biureta zapewnia dużą dokładność i wiarygodność analiz roztworów. Precyzyjne pomiary są nieodzowne w chemii, gdzie jakość wyników ma kluczowe znaczenie.
Te trzy narzędzia stanowią podstawowe wyposażenie każdego laboratorium chemicznego, umożliwiając dokładne i powtarzalne pomiary. Są fundamentem wielu doświadczeń, które rozwijają naszą wiedzę o chemii.
Metoda wyporu
Metoda wyporu, oparta na prawie Archimedesa, jest doskonałym narzędziem do pomiaru objętości ciał stałych o nieregularnych kształtach. Proces ten polega na zanurzeniu próbki w cieczy, co skutkuje wypieraniem jej objętości. Dzięki pomiarowi ilości wypartej cieczy możemy dokładnie określić objętość badanej próbki. Technika ta jest szczególnie przydatna w przypadku substancji, których kształt uniemożliwia wykorzystanie standardowych wzorów geometrycznych.
Wypór znajduje szerokie zastosowanie nie tylko w laboratoriach, ale również w analizach materiałowych. Ta metoda gwarantuje precyzyjne i wiarygodne wyniki pomiarów. Ponadto, jest niezwykle ważna w laboratoriach chemicznych i fizycznych, gdzie dokładność pomiarów objętości odgrywa kluczową rolę. Dzięki jej zastosowaniu możemy skutecznie badać substancje stałe oraz zgłębiać ich fizyczne właściwości.
Zastosowanie czujników ultradźwiękowych i gazometru
Czujniki ultradźwiękowe oraz gazometry to nowoczesne narzędzia pomiarowe, które mają szerokie zastosowanie w laboratoriach. Ich głównym celem jest precyzyjne określanie objętości różnych substancji.
Czujniki ultradźwiękowe działają poprzez emisję fal ultradźwiękowych. Po odbiciu się tych fal od powierzchni próbki, możliwe jest dokładne zmierzenie objętości bez fizycznego kontaktu z substancją. Takie podejście zapewnia nie tylko czystość próbki, ale również minimalizuje ryzyko błędów pomiarowych.
Gazometr, z kolei, jest kluczowym narzędziem do pomiaru objętości gazów. W kontekście eksperymentów chemicznych jego rola jest nie do przecenienia, ponieważ precyzyjny pomiar gazów jest niezbędny do prawidłowej analizy reakcji chemicznych. Dzięki zaawansowanej technologii, gazometry dostarczają dokładnych wartości, co ma ogromne znaczenie w stechiometrii.
Stosowanie czujników ultradźwiękowych oraz gazometrów nie tylko zwiększa dokładność pomiarów, ale także przyspiesza proces analizy. Te innowacyjne urządzenia odpowiadają potrzebom dzisiejszych badań naukowych, dostarczając wiarygodnych danych, które są niezbędne do dalszych eksperymentów i badań.
Jak poprawnie przeliczać jednostki objętości?
Przeliczanie objętości to kluczowy aspekt w chemii i fizyce, który pozwala na precyzyjne dokonanie obliczeń oraz analiz. Wśród najważniejszych jednostek objętości znajdują się:
- centymetr sześcienny (cm³),
- decymetr sześcienny (dm³),
- litr (L),
- metr sześcienny (m³).
Zasady dotyczące przeliczania jednostek są oparte na prostych i intuicyjnych regułach. Na przykład:
- 1 litr odpowiada 1000 cm³,
- 1 metr sześcienny to 1000 litrów.
Aby zmienić jednostki, wystarczy zastosować te relacje. Dla przykładu, aby przeliczyć 2 litry na centymetry sześcienne, należy pomnożyć 2 przez 1000, co daje nam wynik 2000 cm³.
Zamiana jednostek ma również ogromne znaczenie w laboratoriach oraz podczas obliczeń stechiometrycznych, gdzie dokładność jest kluczowa. Dokładne wartości pomagają w unikaniu pomyłek, dlatego warto zapamiętać główne przeliczniki.
Niedokładności w przeliczaniu mogą prowadzić do błędów w wynikach, co w chemii może z kolei wpłynąć na jakość analiz i eksperymentów. Dlatego umiejętność prawidłowego przeliczania jednostek jest absolutnie podstawowa dla każdego chemika i naukowca.
Centymetr sześcienny, decymetr sześcienny, litr, metr sześcienny
Centymetr sześcienny (cm³), decymetr sześcienny (dm³), litr (L) i metr sześcienny (m³) to kluczowe jednostki objętości, które odgrywają istotną rolę w chemii i fizyce. Centymetr sześcienny jest najdrobniejszą z nich, ponieważ 1 dm³ to 1000 cm³.
Decymetr sześcienny, który jest równy jednemu litrowi, najczęściej wykorzystuje się do pomiaru objętości cieczy. Metr sześcienny, stanowiący jednostkę w układzie SI, odpowiada aż 1000 litrom. Dobre zrozumienie tych przeliczeń jest niezwykle ważne, szczególnie w laboratoriach oraz w licznych zastosowaniach technologicznych.
Aby łatwiej przeliczać objętości, warto zapamiętać te powiązania:
- 1 m³ = 1000 dm³,
- 1 m³ = 1 000 000 cm³.
Znajomość tych relacji umożliwia precyzyjne obliczenia i interpretację wyników w kontekście chemicznych eksperymentów oraz badań naukowych.
Zamiana jednostek objętości
Zamiana jednostek objętości to istotny element chemii, który pozwala na przeprowadzenie konwersji między różnymi miarami. W tym celu posługujemy się przelicznikami, które precyzują związki między jednostkami. Przykładowo:
- 1 litr (L) to 1000 centymetrów sześciennych (cm³),
- 1 metr sześcienny (m³) odpowiada 1000 litrom.
Umiejętność przekształcania jednostek jest niezwykle ważna, zwłaszcza w laboratoriach, gdzie dokładność jest kluczowa. W takich miejscach najczęściej spotykamy litry oraz decymetry sześcienne (dm³) do pomiarów objętości cieczy. To właśnie te jednostki dominują w dokumentacji eksperymentalnej.
Podczas konwersji jednostek objętości niezbędne jest staranne przeprowadzenie obliczeń. Wszelkie błędy mogą prowadzić do nieprawidłowych rezultatów badań. Ponadto, znajomość przeliczeń jednostek objętości okazuje się przydatna podczas rozwiązywania zadań w szkołach oraz przy wykonywaniu obliczeń z zakresu fizyki i chemii, co w efekcie ułatwia analizę i interpretację uzyskanych danych.
Zakres zastosowania przeliczeń jednostek objętości jest bardzo szeroki. Obejmuje on zarówno teoretyczne aspekty, jak i praktyczne zastosowania, w tym analizę roztworów oraz różnorodne reakcje chemiczne.
Jak objętość wpływa na reakcje chemiczne i stechiometrię?
Objętość odgrywa fundamentalną rolę w chemii, mając wpływ zarówno na przebieg reakcji chemicznych, jak i na obliczenia stechiometryczne. W kontekście reakcji gazowych, zmiany objętości mają kluczowe znaczenie dla równowagi obiegu reakcji oraz tempa ich zachodzenia. Na przykład, zgodnie z prawem Boyle’a, modyfikując objętość przy stałej temperaturze, wpływamy na ciśnienie, co w konsekwencji oddziałuje na dynamikę reakcji chemicznej.
W stechiometrii objętość jest niezbędna do oszacowania ilości reagentów oraz powstających produktów. Nierzadko posługujemy się stężeniem molowym, aby przeliczyć ilość moli substancji w danej objętości roztworu. Precyzyjne pomiary, takie jak 1 L lub 2 L roztworu, pozwalają dokładnie przewidywać wyniki reakcji i kontrolować efektywność procesów chemicznych.
W laboratoriach chemicznych kluczowe jest zachowanie wysokiej precyzji przy pomiarach objętości, co ma ogromne znaczenie przy planowaniu oraz analizowaniu eksperymentów. Nawet niewielkie błędy w pomiarach mogą prowadzić do znacznych odchyleń między wynikami oczekiwanymi a rzeczywistymi, co może skutkować błędnymi wnioskami. Dlatego istotne jest, aby korzystać z odpowiednich technik pomiarowych oraz znać odpowiednie wzory, by skutecznie przeprowadzać badania chemiczne.
Jakie są typowe błędy przy pomiarze i obliczeniach objętości?
Typowe błędy podczas pomiarów objętości mogą znacząco wpłynąć na wyniki przeprowadzanych eksperymentów chemicznych. Źródła tych błędów są zróżnicowane, ale najczęściej związane są z:
- niedokładnością narzędzi pomiarowych,
- pomyłkami ze strony operatorów.
Często zdarza się, że niewłaściwie interpretowany menisk w cylindrze miarowym czy pipetach prowadzi do błędnych wyników. Dlatego tak istotna jest kalibracja sprzętu, ponieważ niewłaściwie ustawione narzędzia mogą wprowadzać nas w błąd.
Podczas bezpośrednich pomiarów, które opierają się na użyciu cylindra miarowego lub pipety, istnieje ryzyko niewłaściwego odczytania wartości wyświetlanej przez menisk. W bardziej skomplikowanych obliczeniach, takich jak te związane z geometrią, łatwo popełnić błąd w wyniku:
- niedokładności w pomiarach substancji stałych.
Dlatego niezbędne jest stosowanie precyzyjnych metod pomiarowych oraz przeprowadzanie regularnej kalibracji narzędzi.
Błędy pomiarowe mają istotny wpływ na jakość wyników oraz ich interpretację. Wnioski wyciągnięte z eksperymentów mogą prowadzić do niewłaściwych rekomendacji czy decyzji, co w kontekście badań laboratoryjnych jest wyjątkowo niebezpieczne. Dlatego warto zastosować metody, które skutecznie minimalizują błędy. Można tu wprowadzić:
- powtarzalność pomiarów,
- nowoczesne technologie pomiarowe,
- procedury kontrolne,
- które pomogą zapewnić większą dokładność i wiarygodność wyników.
Kiedy stosować określony wzór na objętość w chemii?
Wybór odpowiedniego wzoru do obliczania objętości w chemii odgrywa kluczową rolę. Właściwy wzór zależy od rodzaju substancji, z którą pracujemy. W przypadku substancji stałych i ciekłych, najczęściej stosujemy równanie V = m / d, gdzie V oznacza objętość, m to masa, a d to gęstość materiału. Taki sposób obliczeń jest szczególnie przydatny dla cieczy, takich jak woda czy alkohol, a także dla stałych, jak metale czy minerały.
W sytuacjach, gdy zajmujemy się roztworami i reakcjami chemicznymi, korzystamy z innego wzoru: V = n / Cm, gdy dysponujemy informacją na temat liczby moli (n) i stężenia molowego (Cm). To podejście ma ogromne znaczenie w laboratoriach, gdzie maksymalna precyzja stężeń roztworów jest niezbędna do prawidłowego przebiegu reakcji chemicznych.
Gdy analizujemy gazy, obliczenie ich objętości wymaga zastosowania równania stanu gazu idealnego: PV = nRT. To równanie uwzględnia takie parametry jak:
- ciśnienie (P),
- temperatura (T),
- liczba moli (n).
To pozwala na efektywną analizę gazów w różnorodnych warunkach, uwzględniając zmieniające się wartości.
Dla obiektów o regularnych kształtach, jak prostopadłościany, walce czy kule, stosujemy właściwe wzory geometryczne, które umożliwiają precyzyjne obliczenie objętości. Owe obliczenia są niezwykle istotne w kontekście przeprowadzania eksperymentów chemicznych oraz w analizie chemicznej.
Zrozumienie, kiedy zastosować dany wzór do obliczeń objętości, jest kluczowe dla uniknięcia błędów w tych obliczeniach. Prawidłowe wykorzystanie wzorów ma fundamentalne znaczenie dla jakości doświadczeń laboratoryjnych.
Jakie znaczenie ma objętość w analizie roztworów i eksperymentach laboratoryjnych?
Objętość ma kluczowe znaczenie w analizie roztworów oraz podczas wykonywania eksperymentów w laboratoriach. Dokładne pomiary pozwalają na przygotowanie roztworów o precyzyjnie ustalonym stężeniu molowym, co jest szczególnie istotne w chemii analitycznej. Warto zauważyć, że objętość reagentów ma wpływ na szybkość reakcji chemicznych i ich równowagę.
W laboratoriach zwykle korzysta się z różnych narzędzi, takich jak:
- cylindry miarowe,
- pipety,
- biurety.
Te instrumenty zapewniają wysoką dokładność i pozwalają na uzyskanie powtarzalnych wyników, co jest niezbędne dla wiarygodnych danych. Dzięki precyzyjnym pomiarom mamy możliwość nie tylko prawidłowego przygotowania roztworów, ale również dokładnego określenia ilości reagentów biorących udział w reakcjach, co wpływa bezpośrednio na wyniki przeprowadzanych badań.
Dodatkowo objętość odgrywa znaczącą rolę w stechiometrii, gdzie pozwala na obliczenia dotyczące ilości reagentów uczestniczących w reakcjach chemicznych. Błędy w pomiarach mogą prowadzić do niewłaściwych interpretacji wyników, dlatego tak istotna jest precyzja w tych procesach. Świadomość, jak ważna jest objętość w kontekście chemii, przyczynia się do lepszego przeprowadzania eksperymentów oraz rzetelnej analizy roztworów.