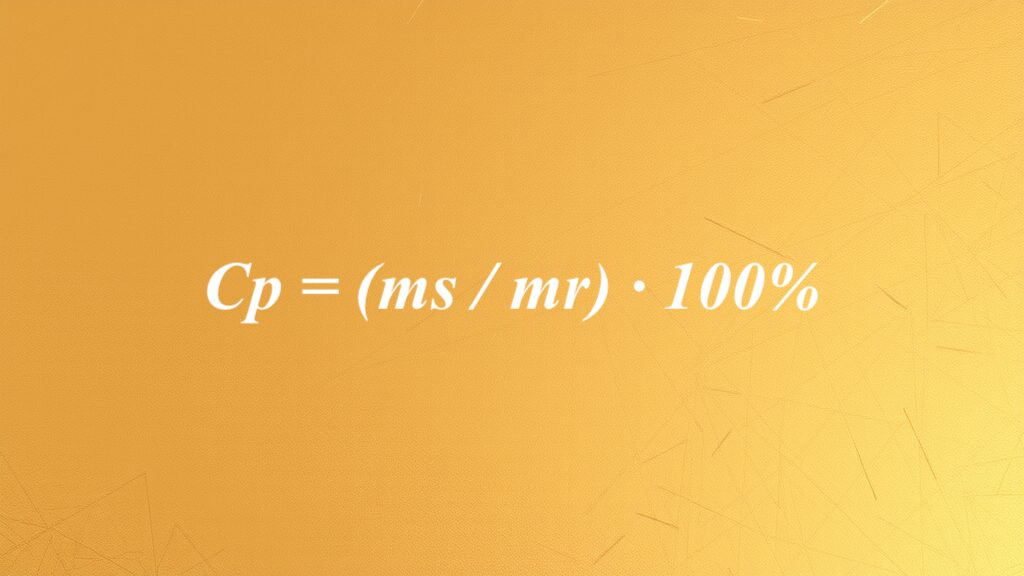Wzór na stężenie procentowe – jak obliczyć stężenie procentowe roztworu?
Stężenie procentowe roztworu jest istotnym parametrem w chemii, określającym ilość substancji rozpuszczonej w całkowitej masie mieszanki. Aby je wyliczyć, stosujemy wzór: Cp = (ms / mr) · 100%. W tym równaniu:
- Cp to stężenie procentowe,
- ms oznacza masę substancji rozpuszczonej, jak na przykład sól czy cukier,
- mr odnosi się do masy całego roztworu, obejmującego zarówno substancję rozpuszczoną, jak i płyn.
Stężenie procentowe ukazuje, ile gramów danej substancji znajduje się w 100 gramach roztworu. Przykładowo, jeśli mamy 5 g soli w 95 g wody (łącznie 100 g roztworu), stężenie wynosi 5%.
To obliczenie często wykorzystuje się w laboratoriach do przygotowywania precyzyjnych mieszanek chemicznych oraz standaryzacji eksperymentów naukowych. Dzięki temu można skutecznie porównywać właściwości różnych związków chemicznych pod kątem ich reakcji czy przewodności.
Podczas wykonywania obliczeń ważne jest dokładne określenie masy substancji i całego roztworu. Jest to kluczowe dla uniknięcia błędów oraz uzyskania dokładnych wyników analizy.
Wzór ogólny na stężenie procentowe
Wzór na stężenie procentowe to kluczowe narzędzie w chemii, które umożliwia dokładne określenie, jaką część masy roztworu stanowi masa substancji rozpuszczonej. Wygląda on tak: Cp = (ms / mr) · 100%, gdzie:
- Cp to stężenie procentowe,
- ms to masa substancji rozpuszczonej,
- mr oznacza całkowitą masę roztworu.
Całkowita masa roztworu (mr) składa się z sumy masy rozpuszczalnika i masy substancji rozpuszczonej. Wykorzystując ten wzór, można precyzyjnie obliczyć proporcje składników w mieszance, co jest istotne przy tworzeniu mieszanin o pożądanych właściwościach fizykochemicznych. Dodatkowo, używanie tego wzoru znacznie upraszcza przeprowadzanie eksperymentów w laboratorium oraz kontrolę jakości wyrobów chemicznych.
Obliczanie zawartości procentowej substancji
Aby ustalić, ile procent substancji znajduje się w roztworze, posługujemy się prostym wzorem matematycznym. Kluczowe jest zrozumienie terminów takich jak masa substancji oraz masa roztworu. Wzór ten przedstawia się następująco: Cp = (ms / mr) * 100%. Gdzie Cp oznacza stężenie procentowe, ms to masa substancji, a mr to całkowita masa roztworu.
Przyjrzyjmy się przykładowi: mamy 10 gramów soli rozpuszczonej w 90 gramach wody, co daje razem 100 gramów roztworu. Stężenie procentowe obliczamy w ten sposób: (10g / 100g) * 100% = 10%. Oznacza to, że sól stanowi 10% masy całego roztworu.
Obliczanie stężenia procentowego jest istotne w wielu dziedzinach, od chemii laboratoryjnej po przemysłową produkcję. Precyzja tych obliczeń ma wpływ na jakość i właściwości finalnego produktu.
Obliczanie stężenia procentowego roztworu
Obliczanie stężenia procentowego roztworu odgrywa kluczową rolę w chemii analitycznej, umożliwiając określenie, jaką część masy stanowi dana substancja. Do wyznaczenia tego można zastosować różne metody, z których najczęściej używaną jest wzór: Cp = (ms / mr) · 100%. W tym równaniu ms to masa substancji rozpuszczonej, a mr oznacza całkowitą masę roztworu. Dla przykładu, jeśli mamy 10 gramów substancji w 200 gramach roztworu, uzyskamy stężenie równe 5%.
Inną opcją jest analiza proporcji masy substancji do masy rozpuszczalnika. Znając jedną z tych wielkości oraz oczekiwaną zawartość procentową, łatwo obliczyć brakujące wartości. Ważne jest jednak unikanie typowych błędów obliczeniowych. Trzeba zwrócić szczególną uwagę na to, by nie pomijać masy rozpuszczalnika i poprawnie zaokrąglać wyniki.
Przy pracy z różnorodnymi stężeniami istotna jest precyzja pomiarów oraz użycie właściwych jednostek. Tylko dokładne obliczenia i prawidłowe zastosowanie wzorów zapewnią wiarygodność wyników w laboratorium chemicznym.
Przykłady obliczeń laboratoryjnych
Obliczanie stężenia procentowego roztworu jest istotne w wielu eksperymentach chemicznych. Na przykład, aby określić ilość cukru w 250-gramowym roztworze, gdzie 100 g stanowi cukier, stosujemy wzór: (masa substancji / masa roztworu) * 100%. W rezultacie otrzymujemy stężenie wynoszące 40%.
Podobnie możemy ustalić stężenie chlorku sodu. Rozpuszczając 10 g NaCl w 250 g wody, całkowita masa roztworu wynosi 260 g. Zastosowanie tego samego wzoru prowadzi do wyniku 3,85% dla stężenia procentowego. Przykłady te pokazują, jak proste obliczenia pozwalają na określenie zawartości procentowej substancji w różnych warunkach laboratoryjnych.
Typowe błędy obliczeniowe
Typowe pomyłki przy obliczaniu stężenia procentowego roztworu często wynikają z niewłaściwego stosowania jednostek masy. Na przykład, niepoprawne przeliczanie gramów na kilogramy może prowadzić do znacznych różnic w wynikach. Innym częstym błędem jest nieprawidłowe dodawanie mas rozpuszczalnika i substancji czynnej, co skutkuje uzyskaniem niepoprawnego wyniku końcowego. Problematyczne bywają także błędne przekształcenia wzorów matematycznych.
Dlatego zawsze warto upewnić się, że:
- wszystkie wartości są poprawnie wstawione do formuły,
- użyte jednostki są jednolite,
- jednostki są właściwie stosowane w całym procesie obliczeń laboratoryjnych.
Unikanie takich błędów jest kluczowe dla osiągnięcia precyzyjnych rezultatów.
Sporządzanie roztworu o określonym stężeniu
Aby stworzyć roztwór o określonym stężeniu, warto poznać kluczowe kroki tego procesu.
- najpierw obliczamy masy składników: substancji, którą chcemy rozpuścić, oraz samego rozpuszczalnika,
- potem precyzyjnie ważymy te ilości,
- następnie starannie je mieszamy, dbając o to, by substancja całkowicie się rozpuściła.
Na przykład, przygotowując 3% roztwór chlorku sodu w wodzie, należy odmierzyć 4,5 g soli na każde 150 g gotowego roztworu. Reszta to woda pełniąca rolę rozpuszczalnika. Dokładne pomiary są niezbędne do osiągnięcia zamierzonego procentu stężenia.
Ten proces wymaga uwagi i precyzji, gdyż nawet niewielkie błędy mogą wpłynąć na właściwości finalnego roztworu. Zachowanie odpowiednich proporcji gwarantuje oczekiwane efekty chemiczne i fizyczne danego preparatu.
Proporcje składników roztworu
Odpowiednie proporcje składników w roztworze są niezbędne do uzyskania pożądanego stężenia. Aby prawidłowo przygotować taki roztwór, konieczne jest precyzyjne zważenie zarówno masy substancji rozpuszczonej, jak i masy rozpuszczalnika.
Na przykład, chcąc stworzyć wodny roztwór chlorku sodu o 3% stężeniu, należy zmieszać:
- 4,5 g chlorku sodu,
- 145,5 g wody.
Wynikiem będzie 150 g gotowego roztworu.
Takie dokładne proporcje pozwalają na precyzyjne obliczenie stężenia przy użyciu wzoru: \((masa\_substancji / masa\_całego\_roztworu) \times 100%\). Ważnym aspektem jest także uwzględnienie jednostek miary oraz dbałość o dokładność pomiarów podczas tworzenia tego typu mieszanin.
Przygotowanie roztworu stężonego i rozcieńczonego
Aby przygotować skoncentrowany roztwór, kluczowe jest precyzyjne odważenie substancji i określenie ilości cieczy, w której ma się rozpuścić. Precyzyjne pomiary składników są niezbędne do osiągnięcia właściwego stężenia.
Przykładowo, do sporządzenia 2% roztworu chlorku sodu potrzebujesz:
- 3 g soli,
- 147 g wody.
Starannie wymieszanie zapewnia równomierne rozprowadzenie substancji.
Rozcieńczone roztwory uzyskuje się poprzez dodanie większej ilości rozpuszczalnika do już istniejącego roztworu skoncentrowanego. W ten sposób zmniejsza się stężenie bez zmiany ilości samej substancji rozpuszczonej. Ważna jest dokładność przy mierzeniu masy i objętości zarówno podczas tworzenia roztworów skoncentrowanych, jak i tych bardziej rozwodnionych. Dzięki temu można zapewnić oczekiwane właściwości chemiczne roztworu.